
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
分析 以KCl、K2SO4、ZnCl2和1L H2O为原料配得相同组成的营养液中各离子物质的量与0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1L H2O的营养液中的离子的物质的量相同,营养液中离子的物质的量分别为:n(Zn2+)=0.2mol,n(Cl-)=0.6mol,n(K+)=1.4mol,n(SO42- )=0.6mol,根据锌离子守恒可知,需要n(ZnCl2)=0.2mol,此时也提供了氯离子0.4mol,再由硫酸根离子守恒得n(K2SO4)=0.6mol,由氯离子守恒,得到氯化钾的物质的量,由此分析解答.
解答 解:以KCl、K2SO4、ZnCl2和1L H2O为原料配得相同组成的营养液中各离子物质的量与0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1L H2O的营养液中的离子的物质的量相同,营养液中离子的物质的量分别为:n(Zn2+)=0.2mol,n(Cl-)=0.6mol,n(K+)=1.4mol,n(SO42- )=0.6mol,根据锌离子守恒可知,需要n(ZnCl2)=0.2mol,此时也提供了氯离子0.4mol,再由硫酸根离子守恒得n(K2SO4)=0.6mol,由氯离子守恒,则n(KCl)=0.6mol-0.4mol=0.2mol,所以KCl、K2SO4、ZnCl2的物质的量各是0.2mol、0.6mol、0.2mol,
故选A.
点评 本题可以根据离子守恒的思想来解决,即根据只有K2SO4可以提供硫酸根,氯化锌提供锌离子等作为解题的入手点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-3c}{2a}$ | B. | $\frac{2b-3c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结 论 | |
| A | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| B | 向硅酸钠溶液中,滴入硫酸 | 可以验证S的氧化性强于Si |
| C | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D | 向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
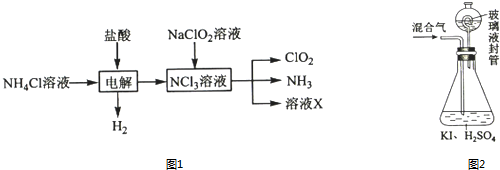
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com