
【题目】某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
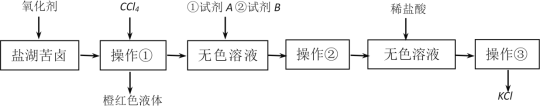
请根据上述流程,回答以下问题:
(1)要从橙红色液体中分离出溴,可采取的操作是____________。
(2)试剂A中如果有两种溶质,它们是_____ 、 ______;如果是一种溶质,它是________。试剂B是__________。
(3)检验SO42- 已除尽的方法是__________________________________________。
(4)操作②名称_______________。
(5)在操作②之后的无色溶液中加入稀盐酸的目的是______________________________。
【答案】蒸馏 BaCl2 KOH Ba(OH)2 K2CO3 静置,在上层清液中继续加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽 过滤 除去未反应的OH-和CO32-
【解析】
根据粗盐的提纯原理、离子共存原理分析实验过程。
(1) 由于溴和CCl4的沸点不同,可用蒸馏的方法分离;
(2)无色溶液中,仍含有K+、Mg2+、SO42-、Cl-,除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,故试剂A中如果有两种溶质,它们是BaCl2 和 KOH,如果是一种溶质,它是Ba(OH)2,试剂B即为:K2CO3;故答案为:BaCl2 , KOH ,Ba(OH)2 , K2CO3 ;
(3) 检验SO42- 已除尽的方法是溶液静置后,在上层清液中继续加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;
(4)由于加入试剂A和试剂B反应后,生成Mg(OH)2和硫酸钡、碳酸钡沉淀,故操作②为过滤;
(5)由于为了让上步反应进行完全,将Mg2+和Ba2+完全沉淀,BaCl2 ,KOH, K2CO3一定过量,故反应后溶液中仍含有CO32-和OH-,故在操作②之后的无色溶液中加入稀盐酸目的是:除去未反应的OH-和CO32-。


科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:

(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。

(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,在金属元素与非金属元素的分界线附近可以找到( )
A.作为催化剂的材料B.电子工业上的半导体材料
C.制造农药的材料D.制造耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染,营造安全的生态环境已成为全人类的共识。
①天然水中杂质较多,常需加入明矾、氯化铁等作混凝剂进行处理,混凝剂溶于水后生成的胶体可以吸附水中的悬浮颗粒。请以氯化铁为例,用离子方程式表示该净水原理_________。
②垃圾处理要遵循无害化、减量化和________的原则。
③在汽车尾气系统中装置催化转化器,由于含铅化合物会使____________,所以装有催化转化器的汽车必须使用无铅汽油。
(2)保证食品、药品安全,保持营养均衡,是人体健康的基础。
①人体需要的营养素主要有糖类、油脂、蛋白质、________、维生素和水。在氢、氮、铁、氯、钙这几种元素中,属于人体生命活动必需的微量元素是________。
②抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、淀粉。写出该抗酸药发挥功效时的离子方程式:__________________________。
③如果不注意控制酸性食物的摄入,就会导致血液偏酸,甚至形成“________症”,引起人体缺钙、血液黏度增大等。
④漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是____________________________。
(3)丰富多彩的材料为人类的生存和发展创造了完美的物质条件。
石英玻璃的主要成分为____________(填化学式)。有机玻璃受热时会软化,易于加工成型。有机玻璃是一种____________(选填“橡胶”或“纤维”或“塑料”)。有些塑料只是在制造过程中受热时能变软,可以塑制成一定的形状,但加工成型后就不会受热熔化,具有__________。橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为__________结构,从而增大橡胶的强度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com