
| A. | 102 | B. | 104 | C. | 120 | D. | 122 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题

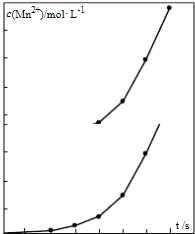
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
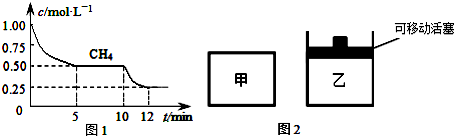
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A气体是NH3,B气体是CO2 | |
| B. | 侯氏制碱法的工艺过程应用了物质溶解度的差异 | |
| C. | 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+] | B. | Ka(HF) | C. | $\frac{[{F}^{-}]}{[{H}^{+}]}$ | D. | $\frac{[{H}^{+}]}{[HF]}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com