
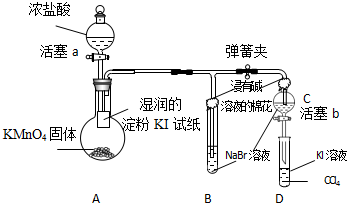
 ;生成标准状况下的氯气体积共0.112L,即
;生成标准状况下的氯气体积共0.112L,即| 0.112 |
| 22.4 |
 ;6.02×1021;
;6.02×1021;

科目:高中化学 来源: 题型:
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
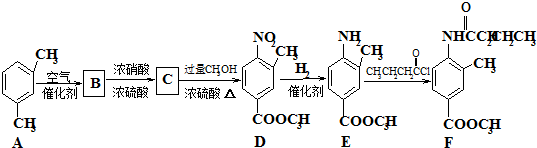
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
| ||
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
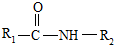 在一定条件下可水解为
在一定条件下可水解为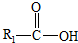 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2OH
| |||
B、水杨酸( )中加入NaHCO3溶液: )中加入NaHCO3溶液: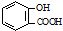 +2HCO3→ +2HCO3→ +2CO2↑+2H2O +2CO2↑+2H2O | |||
| C、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期的实验目的或结论 |
| A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质含钠元素 |
| B | 将SO2气体通入某红色溶液中,溶液褪色 | 该溶液一定为品红溶液 |
| C | 蔗糖溶液中加入少量稀硫酸、加热,然后加入银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
| D | 除去苯中混有的少量苯酚 | 加入浓溴水后过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | ≤1 |
| 2 | Au3++4Cl-?Au4Cl4- | ≥1 |
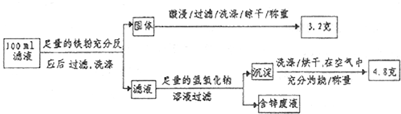
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com