
| A. | 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质” | |
| B. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 | |
| C. | 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂 | |
| D. | 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2 |
分析 A.任何食物蔬菜都是由化学物质组成;
B.乙醇无强氧化性;
C.碳酸钠能够与酸反应消耗氢离子,碳酸氢钠受热分解生成二氧化碳;
D.二氧化碳暂时没有列入污染指数项目.
解答 解:A.任何食物蔬菜都是由化学物质组成,绝对不含任何化学物质的蔬菜不存在,故A错误;
B.乙醇无强氧化性,酒精能使蛋白质变性而杀菌消毒,故B错误;
C.碳酸钠能够与酸反应消耗氢离子,所以面食加工时加入少量苏打粉时是防止酸败,碳酸氢钠受热分解生成二氧化碳,所以加入少量小苏打粉时是作膨松剂,故C正确;
D.二氧化碳暂时没有列入污染指数项目,故D错误;
故选:C.
点评 本题考查了化学与生产生活,涉及绿色食品与食品添加剂、蛋白质性质、环境污染与治理,掌握基础是解题关键,题目难度不大,注意对相关知识的积累.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 烧碱 | H2SO4 | 盐酸 | CaO | SO3 |
| B | 纯碱 | HCl | 冰醋酸 | Na2O2 | CO2 |
| C | NaOH | CH3COOH | 冰水混合物 | Na2O | SO2 |
| D | KOH | HNO3 | 胆矾 | Al2O3 | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
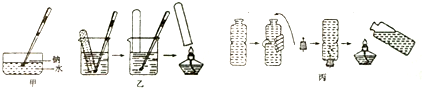
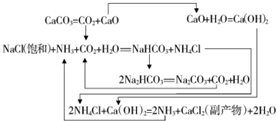
 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.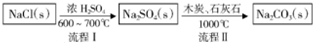
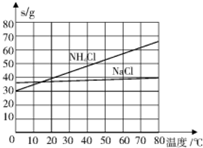
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1 mol Na2CO3晶体中含离子总数大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
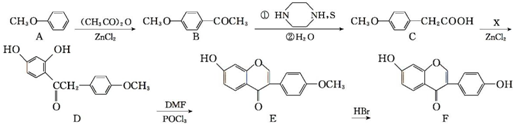
 ,写出该反应的化学方程式
,写出该反应的化学方程式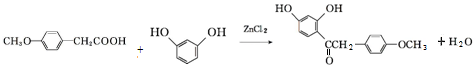 .
.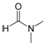 )在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.
)在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N. 或
或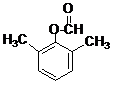 .(写出其中一种的结构简式)
.(写出其中一种的结构简式)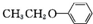 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备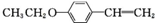 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,11.2LNO2气体含有的分子数为 NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质在氧气中燃烧生成Y2O | |
| B. | X、W的简单离子均能促进水的电离 | |
| C. | 原子半径由小到大的顺序为X<Y<Z<W | |
| D. | Z单质加入到Y的可溶性盐溶液中,可以置换出Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com