
(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是 。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.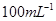 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
g.
②取上述制得的KMnO4产品0.316g,酸化后用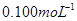 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: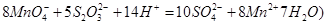
(1)将③中MnO2回收利用(2分)
(2)3MnO42-+4H+=MnO2↓+2MnO4-+2H2O(2分)
(3)①3.95(3分)
② 8KMnO4 ~ 5S2O32-
8×158 g 5 mol
0.316 g×w 0.100 mol·L-1×12.00 mL×10-3 L·mL-1
w =96%(或0.96)(5分)
【解析】(1)制备过程中,为了提高原料的利用率,一般是原料的循环使用,即可以将将③中MnO2回收利用。
(2)根据反应物和生成物可知,反应的方程式为3MnO42-+4H+=MnO2↓+2MnO4-+2H2O。
(3)①250mL0.100mol/L 标准Na2S2O3溶液中,溶质的物质的量是0.025mol,质量是0.025mol×158g/mol=3.95g。
②本题可以通过关系式计算。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:013
|
高锰酸钾(KMnO4)是一种强氧化剂,在化学实验中被大量使用,它的性质和用途正确的是 | |
| [ ] | |
A. |
为了增强其氧化性,在配制时加入一定浓度的盐酸 |
B. |
该物质在反应中能发生还原反应,也可发生氧化反应 |
C. |
可用酸化的该溶液除去甲烷中的乙烯气体 |
D. |
Mn元素为最高价+7,故含有最高价元素的化合物,均有强氧化性,如浓硫酸、浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省徐州市高三模底考试化学试卷(带解析) 题型:填空题
(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是 。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.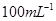 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
g.
②取上述制得的KMnO4产品0.316g,酸化后用 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: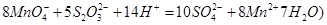
查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com