
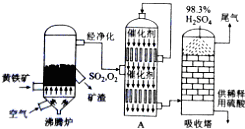
| A. | 硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 | |
| B. | 沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 | |
| C. | SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 | |
| D. | SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
分析 根据工业上接触法制硫酸的原料、过程,制硫酸原料为硫铁矿,进样前首先将硫铁矿粉碎,增大接触面积;生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,在接触室中的催化剂可以加快反应的速率,但不会影响平衡的移动,二氧化硫的转化率不会改变;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全等来解题.
解答 解:A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B.从沸腾炉出来的炉气需净化是因为其中带有的杂质气体会让下一步接触室里面的催化剂中毒,催化剂中毒会影响反应的进度,故B错误;
C.一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故选D.
点评 本题考查了工业上接触法制硫酸的原料、过程,明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因是解答本题的关键,并注意理论与实际生产中的差别来解答.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.22mol | B. | 0.40mol | C. | 0.42mol | D. | 0.62mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.80L | B. | 58.24L | C. | 80.64L | D. | 116.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:a>d>c | |
| B. | 简单离子的半径:c>d>a>b | |
| C. | a、b、c简单离子都会破坏水的电离平衡 | |
| D. | a、b、d的最高价氧化物对应的水化合物两两皆能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据①可推出矿灰中一定含有SiO2 | |
| B. | 根据②可推出矿灰中一定含有KCl | |
| C. | 根据③可推出矿灰中一定含有FeO和Fe2O3 | |
| D. | 根据④可推出固体丙中一定不含MgO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com