
| A. | pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同 | |
| B. | 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0 | |
| C. | 在含浓度都为0.01mol/L的Cl-、CrO42-的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12] | |
| D. | 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同 |
分析 A.酸抑制水电离,易水解的盐促进水的电离;
B.0.1mol/L的醋酸中氢离子的浓度小于0.1mol/L;
C.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
D.根据影响铵根离子水解平衡移动的因素分析.
解答 解:A.pH值都为4的稀盐酸中水的电离受到抑制,NH4Cl溶液中水的电离受到促进,所以两种溶液中水的电离程度不相同,故A错误;
B.0.1mol/L的醋酸中氢离子的浓度小于0.1mol/L,0.1mol/L的NaOH溶液中氢氧根离子浓度等于0.1mol/L,所以lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]<0,故B错误;
C.AgCl饱和所需Ag+浓度c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{0.01}$=1.8×10-8mol/L,
Ag2CrO4饱和所需Ag+浓度c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.9×1{0}^{-12}}{0.01}}$mol/L=4.36×10-5mol/L,则1.8×10-8mol/L<4.36×10-5mol/L),所以Cl-先沉淀,故C正确;
D.浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,铵根离子水解浓度减小,由于CH3COO-水解显碱性,促进铵根离子水解,所以CH3COONH4溶液中,c(NH4+)较小,故D错误.
故选C.
点评 本题考查弱电解质的电离、盐的水解、溶度积常数的有关计算,侧重于学生的分析能力和计算能力的考查,注意把握弱电解质的电离特点以及影响因素、水解平衡移动,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
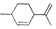 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有9种 | ||
| C. | 常温下呈固态,比水重 | D. | 能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 结论 |
| A | 相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入到等体积、等浓度的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL0.1mol•L-1Na2S溶液中滴入几滴0.1mol•L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1mol•L-1CuSO4溶液,又产生黑色沉淀 | 溶度积:KSP(ZnS)>KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
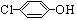 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
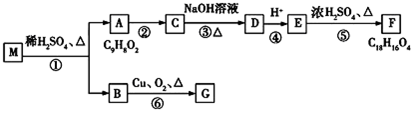
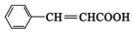 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或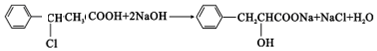 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.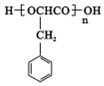 或
或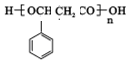 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cl-、Na+、SO42- | B. | MnO4-、K+、Cl-、Na+ | ||
| C. | NH4+、SO42-、OH-、Na+ | D. | CO32-、HCO3-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com