
| A.0.05 | B.0.5 | C.0.55 | D.1.1 |
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
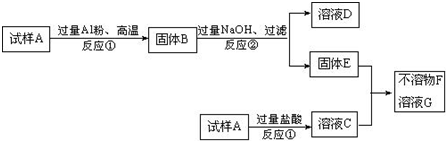
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
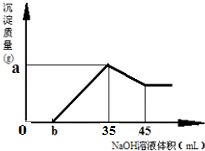
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨气是生产硝酸的重要原料 | B.甲烷与氯气反应可制得纯净的一氯甲烷 |
| C.铁制容器可用来盛放稀硝酸 | D.油脂经皂化反应可获得高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氟酸具有强酸性,可用于雕刻玻璃 |
| B.氨气显碱性,可用P2O5或无水CaCl2干燥 |
| C.MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
| D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O |
| C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D.过量铁与浓硫酸加热反应可以得到氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
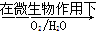 Fe2++SO42-
Fe2++SO42-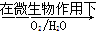 Fe3+
Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com