
【题目】若NA表示阿伏加德罗常数的值,在3(NH4)2SO4 ![]() N2 + 4NH3↑+ 3SO2↑+6H2O中,当有12NA个电子转移时,以下说法正确的是
N2 + 4NH3↑+ 3SO2↑+6H2O中,当有12NA个电子转移时,以下说法正确的是
A.有6 molS (+6价)被还原B.有4 mol SO2生成
C.有4 molN (-3价)被还原D.有8 mol (NH4)2SO4分解
【答案】A
【解析】
(NH4)2SO4在强热分解的产物是SO2、N2、NH3和H2O,其中N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4,结合化合价的变化分析解答。
A.反应中S元素化合价由+6价降低到+4价,被还原,则当有12NA个电子转移时,有6molS被还原,故A正确;
B.反应中N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4,由方程式可知,转移12mol电子,有6mol SO2生成,故B错误;
C.反应中N元素化合价由-3价升高到0价,被氧化,故C错误;
D.反应中N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4,由方程式可知,当有3mol (NH4)2SO4参加反应时,生成3mol SO2,转移6mol电子,则转移12mol电子,有6mol(NH4)2SO4分解,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。
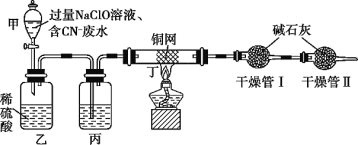
操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为________________;装置乙中反应的离子方程式为________________。
(2)装置丙中的试剂是________________,装置丁的作用是________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为________________。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会________________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________(填方案编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: ![]() (g)
(g)![]()
 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。
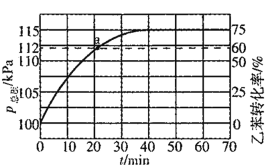
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的![]() ______。
______。
(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:
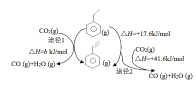
①b=_______kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________。
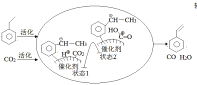
a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有(![]() )
)
d.该催化剂可提高乙苯的平衡转化率
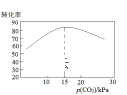
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)=CO2(g) △H1 、C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原的化合反应是
A.Na2CO3+CaCl2===CaCO3↓+2NaClB.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
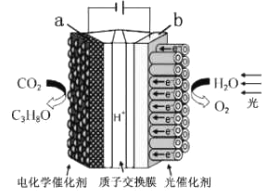
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池原理可以设计原电池,实现多种用途
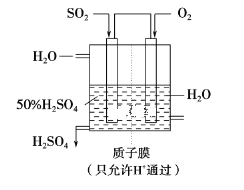
(1) 可以用如图所示装置吸收SO2并制取硫酸,写出通入SO2和O2的电极的电极反应式及反应的总方程式。
负极________________________________
正极________________________________
总反应_________________________________________。
(2) 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
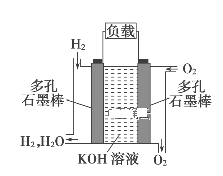
试回答下列问题:
①图中通过负载的电子流动方向________(填“向左”或“向右”)。
②写出氢氧燃料电池工作时电极反应方程式。
正极:_________________________,负极:____________________________,
③若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
正极反应式为__________________________________________________;
负极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
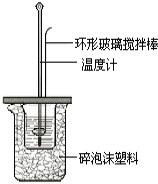
【题目】某实验小组用0.5mol/L NaOH溶液和0.5mol/L硫酸溶液进行中和热的测定。
Ⅰ.准备仪器
(1)环形玻璃搅拌棒__________(填“能”或“不能”)改为环形金属(如铜)棒,其原因是__________。
(2)碎泡沫的作用是______________,终止温度应为反应的最________(填“高”或“终”)温度。
II.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
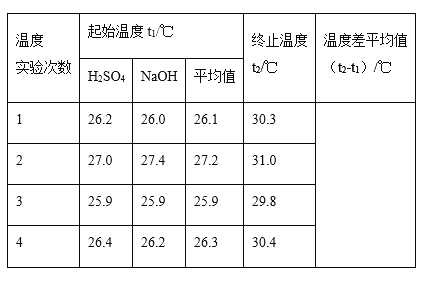
(1)四次实验所得到的温度平均值为__________℃。
(2)取50mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热△H =_____(取小数点后一位)。
②上述实验数值结果与573KJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.反应时未用搅拌器搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com