
����Ŀ����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ����Fe3+��I2�����ʵ�����n��Cl2���ı仯��ͼ��ʾ����ش��������⣺ 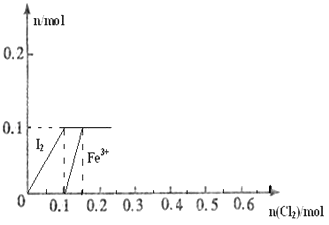
��1����ͼ��֪��I����Fe2+��I2�������ӵĻ�ԭ����ǿ������˳��Ϊ���� ��
��2����n��Cl2��=0.12molʱ����Һ�е�������ҪΪ �� �ӿ�ʼͨ��Cl2��n��Cl2��=0.12molʱ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��3������Һ��n��Cl������n��IO3����=8��1ʱ��ͨ���Cl2�ڱ�״���µ����Ϊ ��
���𰸡�
��1��I����Fe2+��I2
��2��Fe2+��Fe3+��Cl����5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2
��3��8.96L
���������⣺��1����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ��������ԭ��Ӧ�л�ԭ��Խǿ����Խ��Һʧ���ӣ��ɴ�˵��I����Fe2+��I2�������ӵĻ�ԭ����ǿ������˳��ΪI����Fe2+��I2 �� ���Դ��ǣ�I����Fe2+��I2����2������ͼ��Ϸ�ӦCl2+FeI2=FeCl2+I2֪����ͨ��0.1molCl2ʱ��������ȫ���������ɵⵥ�ʣ��⻯���������ʵ�����0.1mol����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ���Ե�ͨ��Cl2��n��Cl2��=0.12molʱ���������������ӷ�Ӧ���������ӣ�2Fe2++Cl2=2Fe3++2Cl�� �� ͨ�����������ʵ�����0.02molʱ����0.04mol�������ӱ���������ʣ0.06mol�������ӣ�������Һ�д��ڵ�������Fe2+��Fe3+��Cl�� �� ���������ӷ�Ӧ����ʽΪ5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2 �� ���Դ��ǣ�Fe2+��Fe3+��Cl����5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2����3����������ת��Ϊ���������ʱ������������ȫת��Ϊ�����ӣ������������ʵ�����x���������ӵ����ʵ�����8x������������ԭ��Ӧ�е�ʧ��������ȵ�x��6+��0.2��x����1+0.1��1=8x��1��x=0.1��������Һ�е���������ʵ�����0.1mol�������ӵ����ʵ�����0.8mol������Cl2��2Cl��֪�����������ʵ�����0.4mol�����������=0.4mol��22.4L/mol=8.96L�����Դ��ǣ�8.96L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2 ![]() 2NO+O2������̶����ܱ������У��ﵽƽ��״̬�ı�־�ǣ� �� �ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
2NO+O2������̶����ܱ������У��ﵽƽ��״̬�ı�־�ǣ� �� �ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ѹǿ���ٸı��״̬
��������ƽ����Է����������ٸı��״̬��
A.�٢ܢޢ�
B.�ڢۢݢ�
C.�٢ۢܢ�
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е�λ�������ʾ������XԪ�ص�ԭ���ڲ��������������������һ�룬������˵������ȷ���ǣ� �� 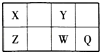
A.����W�����γ�Na2W2������
B.��Z��Y��ɵ�����������ʱ�ܵ���
C.W�õ���������Qǿ
D.X�ж���ͬ�������壬��Y������ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե�ʯ��[��Ҫ�ɷ�ΪCa��OH��2��CaCO3]Ϊԭ���Ʊ�KClO3��������ͼ1��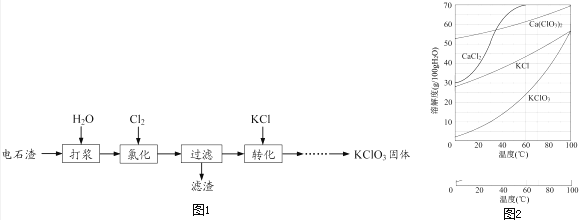
��1���Ȼ����̿��Ƶ�ʯ����������75�����ҽ��У��Ȼ�ʱ����Cl2��Ca��OH��2��������Ca��ClO��2�ķ�Ӧ��Ca��ClO��2��һ��ת��ΪCa��ClO3��2 �� ����Ca��ClO��2 �ֽ�ΪCaCl2��O2 ��
������Ca��ClO��2�Ļ�ѧ����ʽΪ ��
�����Cl2ת��ΪCa��ClO3��2��ת���ʵĿ��д�ʩ��������ţ���
A���ʵ�����ͨ��Cl2���� B����ֽ��转�� C����ˮʹCa��OH��2��ȫ�ܽ�
��2���Ȼ�������Cl2 ת��ΪCa��ClO3��2���ܷ�Ӧ����ʽΪ��
6Ca��OH��2+6Cl2�TCa��ClO3��2+5CaCl2+6H2O
�Ȼ���ɺ���ˣ�
����������Ҫ�ɷ�Ϊ���ѧʽ����
����Һ��Ca��ClO3��2��CaCl2�����ʵ���֮��n[Ca��ClO3��2]��n[CaCl2]1��5�����������������=������
��3������Һ�м����Թ���KCl����ɽ�Ca��ClO3��2ת��ΪKClO3 �� ����Һ��KClO3�ĺ���Ϊ100gL��1 �� �Ӹ���Һ�о����ܶ������KClO3����ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������⣺ʵ������Ҫ��ȡһƿ���������������������ͼ������ҩƷ�ɹ�ʹ�ã� 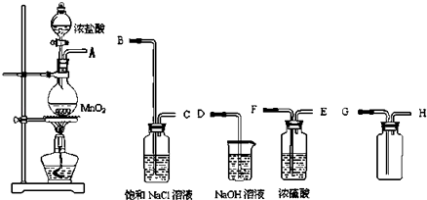
��1��ʵ������ȡ������ԭ����������HCl�����ֵ������� ��
��2������������������ȷ˳���ǣ�����ӿڴ�����ĸ���� �� �� �� �� �� �� ��
��3��������װ���У��ֱ�ʢװ��һЩ��Һ����˵����װ��Һ�����ã�����ʳ��ˮ����������Ũ��������������������Ƶ������� ��
��4��ʢװNaOH��Һ���Լ�ƿ�з����Ļ�ѧ��ӦΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ㶨���ݻ����ֲ���������н��������·�Ӧ��H2��g��+I2��g��2HI��g������˵���÷�Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A.������ ![]()
B.�����ڵ�ѹǿ���ٱ仯
C.����1mol H��H��ͬʱ����2mol H��I
D.��������ɫ���ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��ϡ��˵����ȷ���ǣ� ��
A.��1 L 0.1molL��1��Ba��OH��2��Һ��ˮϡ��Ϊ2L��pH=13
B.pH=3�Ĵ�����Һ��ˮϡ��100����pH=5
C.pH=4��H2SO4��ˮϡ��100������Һ����ˮ���������[H+]=1��10��6molL��1
D.pH=8��NaOH��Һ��ˮϡ��100������pH=6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����ѧ�̲���Ԫ�����ڱ���һ���֣����б��A��Q14��Ԫ�أ��Իش��������⣺ 
��1�����ϱ����г��Ķ�����Ԫ���У���������ʻ�ѧʽ�� ԭ�Ӱ뾶��С���ǣ���ϡ������Ԫ�أ��������ӻ�ԭ����������������������Ӧ��ˮ������������ǿ���� ��
��2��F��G��Ԫ����Ƚϣ������Խ�ǿ�����������ƣ���������֤�ý��۵�ʵ���� �� �����ţ� a�����ڿ����з����Ѿõ�������Ԫ�صĿ�״���ʷֱ������ˮ��
b����������Ԫ�صĵ��ʷ�ĩ�ֱ��ͬŨ�ȵ����ᷴӦ
c����������Ԫ�صĵ��ʷ�ĩ�ֱ����ˮ���ã��������̪��Һ
d���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
��3��BԪ���γɵĵ��ʵĽṹʽΪ �� E2C2�ĵ���ʽΪ ��
��4��д��E������������Ӧ��ˮ������G���ʷ����ķ�Ӧ�����ӷ���ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com