
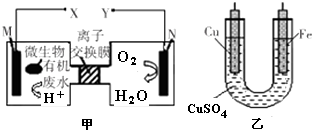
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
分析 根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,据此分析解答.
解答 解:根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,
A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,A错误;
B.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,故B错误;
C.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+,故C正确;
D、当N电极消耗0.25mol氧气时,则转移0.25×4=1mol电子,所以铁电极增重0.5mol×64g/mol=32g,故D错误.
故选C.
点评 本题考查了原电池原理以及电镀原理,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题

| A. | 该有机物分子式为 C10H10O4 | |
| B. | 1mol该有机物与 H2发生加成时最多消耗H2 5 mol | |
| C. | 1mol该有机物与足量溴水反应时最多消耗Br23 mol | |
| D. | 1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
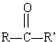 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$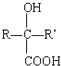 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子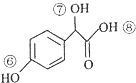 的说法正确的是AD.
的说法正确的是AD. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
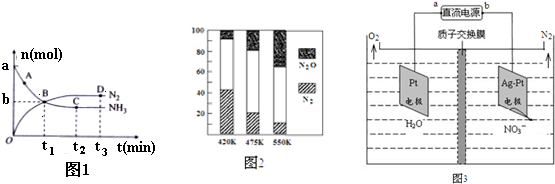
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
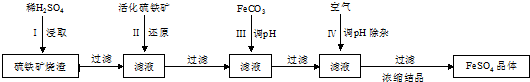
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
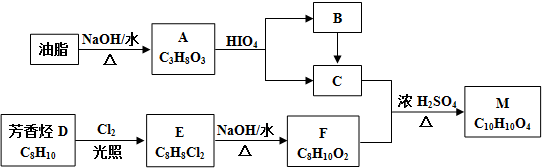
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
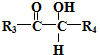 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+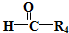
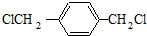 .
.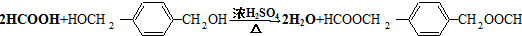 .
.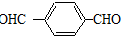
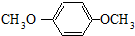

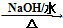 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 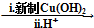 HCOOH
HCOOH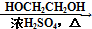 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
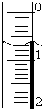 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com