
| A. | ①③⑤⑦ | B. | ②④ | C. | ①③④⑦ | D. | ③⑤ |
分析 ①托盘天平的感量为0.1g;
②量筒的规格应与体积接近;
③NaCl溶于水,可蒸发获得;
④容量瓶具有规定的规格;
⑤浓硝酸光照分解,可氧化橡胶;
⑥用导管直接通入水,易发生倒吸;
⑦浓碱液沾到皮肤上,要立即用大量水冲洗,降低其浓度.
解答 解:①托盘天平的感量为0.1g,则用托盘天平称取2.5g NaCl,故正确;
②量筒的规格应与体积接近,应选10mL量筒量取5.2mL盐酸,故错误;
③NaCl溶于水,可蒸发获得,则用蒸发皿加热NaCl溶液可以得到NaCl晶体,故正确;
④容量瓶具有规定的规格,则用100mL容量瓶配制95mL 0.1mol•L-1H2SO4溶液,故正确;
⑤浓硝酸光照分解,可氧化橡胶,用玻璃塞的棕色试剂瓶存放浓HNO3,故错误;
⑥用导管直接通入水,易发生倒吸,应收集后再制备氨气水,故错误;
⑦浓碱液沾到皮肤上,要立即用大量水冲洗,降低其浓度,然后涂上稀硼酸溶液,操作合理,故正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间小于10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
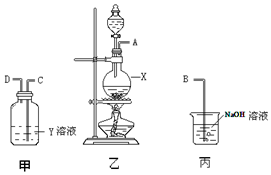 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
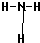 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.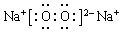 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | Ag(s)+$\frac{1}{2}$Cl2(g)═AgCl(s)△H=-127 kJ•mol-1 | |
| C. | HgO(s)═Hg(l)+$\frac{1}{2}$O2(g)△H=+91 kJ•mol-1 | |
| D. | H2O2(l)═$\frac{1}{2}$O2(g)+H2O(l)△H=-98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com