
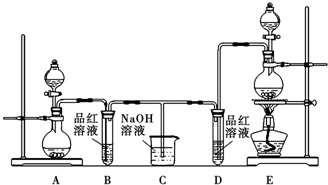
·ÖĪö £Ø1£©ŹµŃéŹŅĄūÓƶžŃõ»ÆĆĢÓėÅØŃĪĖįŌŚ¼ÓČČĢõ¼žĻĀÖʱøĀČĘų£¬·“Ӧɜ³ÉĀČ»ÆĆĢ”¢ĀČĘųÓėĖ®£¬ÓĆEÖʱøĀČĘų£¬ÓĆAÖʱø¶žŃõ»ÆĮņ£»
£Ø2£©¶žŃõ»ÆĮņµÄĘư׊ŌŹĒĄūÓƶžŃõ»ÆĮņŗĶÓŠÉ«ĪļÖŹ»ÆŗĻÉś³É²»ĪȶØĪŽÉ«ĪļÖŹ£¬¼ÓČČČÜŅŗŹ±ÄÜÖŲŠĀ±ä³ÉŗģÉ«£¬“ĪĀČĖįµÄĘư׊ŌŹĒĄūÓĆ“ĪĀČĖįµÄĒæŃõ»ÆŠŌ£¬¼ÓČČĶŹÉ«ŗóµÄČÜŅŗ²»ÄÜ»Ųø“ŗģÉ«£»
£Ø3£©¶žŃõ»ÆĮņ”¢ĀČĘų¾łÓŠ¶¾£¬Ö±½ÓÅÅ·Å»įĪŪČ¾æÕĘų£»
£Ø4£©¶žŃõ»ÆĮņÓėĖ®»ÆŗĻµĆµ½ŃĒĮņĖį£¬¾ßÓŠĖįµÄĶØŠŌ£¬¶žŃõ»ÆĮņ²»ÄÜĘÆ°×Ėį¼īÖøŹ¾¼Į£»
£Ø5£©SO2ÓėCl2ŅŌĢå»ż±Č1£ŗ1»ģŗĻŗóĶØČėĖ®ÖŠ£¬Ē”ŗĆ·¢Éś£ŗSO2+Cl2+2H2O=H2SO4+2HCl£¬æÉŅŌÓĆĘ·ŗģČÜŅŗ¼ģŃéŹĒ·ńĒ”ŗĆĶźČ«·“Ó¦£®
½ā“š ½ā£ŗ£Ø1£©ŹµŃéŹŅĄūÓƶžŃõ»ÆĆĢÓėÅØŃĪĖįŌŚ¼ÓČČĢõ¼žĻĀÖʱøĀČĘų£¬·“Ӧɜ³ÉĀČ»ÆĆĢ”¢ĀČĘųÓėĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+2H2O+Cl2”ü£¬ÓĆEÖʱøĀČĘų£¬ÓĆAÖʱø¶žŃõ»ÆĮņ£¬
¹Ź“š°øĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+2H2O+Cl2”ü£»E£»
£Ø2£©B×°ÖĆÖŠ¶žŃõ»ÆĮņŗĶÓŠÉ«ĪļÖŹ»ÆŗĻÉś³É²»ĪȶØĪŽÉ«ĪļÖŹ£¬Ź¹Ę·ŗģČÜŅŗŗģÉ«ĶŹČ„£¬ŌŁ¼ÓČČBÖŠĶŹÉ«ŗóČÜŅŗŹ±£¬ÓÖ»Ųø“ŗģÉ«£¬
¹Ź“š°øĪŖ£ŗČÜŅŗÓÉĪŽÉ«±äĪŖŗģÉ«£»
£Ø3£©¶žŃõ»ÆĮņ”¢ĀČĘų¾łÓŠ¶¾£¬Ö±½ÓÅÅ·Å»įĪŪČ¾æÕĘų£¬×°ÖĆCµÄ×÷ÓĆŹĒ£ŗĪüŹÕ¶ąÓąµÄSO2ŗĶCl2£¬
¹Ź“š°øĪŖ£ŗĪüŹÕ¶ąÓąµÄSO2ŗĶCl2£»
£Ø4£©¶žŃõ»ÆĮņÓėĖ®»ÆŗĻµĆµ½ŃĒĮņĖį£¬¾ßÓŠĖįµÄĶØŠŌ£¬¶žŃõ»ÆĮņ²»ÄÜĘÆ°×Ėį¼īÖøŹ¾¼Į£¬ČÜŅŗŃÕÉ«±äŗģ£¬
¹Ź“š°øĪŖ£ŗČÜŅŗ±äŗģ£»
£Ø5£©SO2ÓėCl2ŅŌĢå»ż±Č1£ŗ1»ģŗĻŗóĶØČėĖ®ÖŠ£¬Ē”ŗĆ·¢Éś£ŗSO2+Cl2+2H2O=H2SO4+2HCl£¬Ć»ÓŠĘųĢåŹ£Óą£¬Ć»ÓŠĘư׊Ō£¬ŹµŃéÖ¤Ć÷SO2ÓėCl2ŹĒ·ńĒ”ŗĆĶźČ«·½°øĪŖ£ŗČ”SO2ŗĶCl2·“Ó¦ŗóµÄŹŌŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬µĪČė¼øµĪĘ·ŗģČÜŅŗ£¬ČōĘ·ŗģ²»ĶŹÉ«Ōņ¶žÕßĶźČ«·“Ó¦£¬ČōĘ·ŗģ²»ĶĖµÄŌņ¶žÕßĪ“ĶźČ«·“Ó¦£¬
¹Ź“š°øĪŖ£ŗ·ń£»SO2+Cl2+2H2O=H2SO4+2HCl£»Č”SO2ŗĶCl2·“Ó¦ŗóµÄŹŌŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬µĪČė¼øµĪĘ·ŗģČÜŅŗ£¬ČōĘ·ŗģ²»ĶŹÉ«Ōņ¶žÕßĶźČ«·“Ó¦£¬ČōĘ·ŗģ²»ĶĖµÄŌņ¶žÕßĪ“ĶźČ«·“Ó¦£®
µćĘĄ ±¾Ģāæ¼²éŹµŃéÖʱø·½°ø”¢“ĪĀČĖįŗĶ¶žŃõ»ÆĮņµÄŠŌÖŹĢ½¾æŹµŃ飬Ć÷Č·ĀČĘųĘư׊ŌÓė¶žŃõ»ÆĮņĘư׊ŌŌĄķ£¬ÕĘĪÕ֊ѧ³£¼ūĘųĢåµÄŹµŃéŹŅÖʱø£¬ÄѶČÖŠµČ£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čܽā ¹żĀĖ Õō·¢½į¾§ | B£® | ¼ÓČČ Čܽā ¹żĀĖ | ||
| C£® | Čܽā ¹żĀĖ ÕōĮó | D£® | Čܽā ¹żĀĖ ·ÖŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| W | X | ||
| Y | Z |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 »·¾³ĪŹĢāŅŃ¾ŹĒĪŅ¹śĆęĮŁµÄÖŲ“óĪŹĢā£®
»·¾³ĪŹĢāŅŃ¾ŹĒĪŅ¹śĆęĮŁµÄÖŲ“óĪŹĢā£®| »Æѧ¼ü | C=O | H-H | C-C | C-H | O-H | C-O |
| ¼üÄÜ/kJ”¢mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹čŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ | B£® | ¶žŃõ»ÆĢ¼ĶØČė±„ŗĶNa2CO3ČÜŅŗ | ||
| C£® | Ć¾ŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕ | D£® | ĀČĘųĶØČėµ½ĀČ»ÆŃĒĢśČÜŅŗÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com