
下列说法中不正确的是
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<O,则该反应能自发进行
B.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3 d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液中水的电离程度相同
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
下列在指定溶液中的各组离子,一定能够大量共存的是
A.无色溶液中:HCO3-、Al3+、Cl-、NO3-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+) = 10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:简答题
(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH=+8. 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH=+90. 4 kJ·mol-1 |
方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
|
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
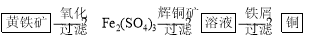
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO一)+c(CH3COOH)
C.pH=3的NaHA溶液中粒子浓度大小为:c( Na+)>c( HA一)>c(A2一)>c(H2A)>c(OH一)
D.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学一化学与技术】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、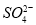 、Br-、
、Br-、 、
、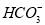 等离子。
等离子。
合理利用海水资源和保护环境是我国可持续发展的重要保证。
I.火力发电燃煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
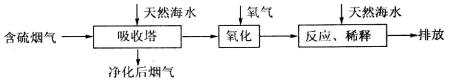
(1)天然海水的pH≈8,呈弱碱性。用离子方程式解释原因___________________________。
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是_______。氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________________________________________________________。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(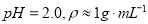 )中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:

(3)你认为往废水中投入_________(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中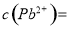 ________。
________。
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%。
若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag)+=__________,是否符合排放标准__________(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
运用化学知识判断,下列说法正确的是
A.地沟油的主要成分是高级脂肪酸甘油酯,可食用
B.NOx、SO2、CO2、PM2.5颗粒都会导致酸雨
C.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害
D.石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气态烯烃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,下列说法中,正确的是
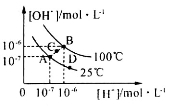
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三下学期3月一模化学试卷(解析版) 题型:选择题
一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
A.MnO2 B.KClO3 C.KMnO4 D.Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加少量的水形成绿色溶液
B.检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色
C.在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解
D.铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com