
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论错误的是( )
A.取一定量固体,溶解,向溶液中通入足量的CO2 , 观察到有晶体析出,说明原固体中一定含有 Na2CO3
B.取一定量固体,溶解,向溶液中加人适量CaO粉末,充分反应后观察到有白色沉淀生成,说明 原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液后有白色沉淀生成,这个现象不能说明原固体中一定含有NaCl
D.称取3.80g固体,加热至恒重,质量减少了 0.620g.用足童稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
【答案】BD
【解析】解:A.向溶液中通入足量的CO2 , 观察到有晶体析出,一定发生Na2CO3+CO2+H2O=2NaHCO3 , 则有晶体析出,说明原固体中一定含有Na2CO3 , 故A正确;B.加CaO,均与Na2CO3、NaHCO3反应生成白色沉淀,则有白色沉淀生成,不能说明原固体中一定含有Na2CO3 , 故B错误;
C.Na2CO3、NaCl均与AgNO3溶液反应生成白色沉淀,则有白色沉淀生成,不能说明原固体中一定含有NaCl,故C正确;
D.称取3.80g固体,加热至恒重,质量减少了0.620g,则
2NaHCO3 |
| Na2CO3+CO2↑+H2O | △m |
168 | 106 | 1 | |
62 | n | 0.62g |
结合固体差量可知n(CO2)= ![]() =0.01mol,则原混合物中含碳酸氢钠为0.02mol,且生成碳酸钠为0.01mol,用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,n(CO2)=
=0.01mol,则原混合物中含碳酸氢钠为0.02mol,且生成碳酸钠为0.01mol,用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,n(CO2)= ![]() =0.02mol,则原混合物中含碳酸钠为0.01mol,二者质量为106g/mol×0.01mol+84g/mol×0.02mol=27.4g,则原固体中含有Na2CO3和NaHCO3、NaCl,故D错误,
=0.02mol,则原混合物中含碳酸钠为0.01mol,二者质量为106g/mol×0.01mol+84g/mol×0.02mol=27.4g,则原固体中含有Na2CO3和NaHCO3、NaCl,故D错误,
故选BD.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据所给信息填空
(1)用0.1mol/L的酸性高锰酸钾溶液测定FeSO4溶液的浓度时,因FeSO4溶液放置时间较长,导致测定结果(填“偏大”、“不变”或“偏小”)
(2)过氧化钠的电子式
(3)选出下列说法中正确的
①氧化物都能与酸或碱的溶液反应
②红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐
③由相同元素组成的物质一定是纯净物
④浓氨水滴加到FeCl3溶液中可制取Fe(OH)3胶体
⑤向容量瓶中转移液体时,玻璃棒不可以接触到容量瓶的瓶口
⑥用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
⑦金属Mg的活泼性比Al强,由Al2O3能与NaOH溶液反应推知MgO也能与NaOH溶液反应
⑧SiO2既能和NaOH溶液反应也能和氢氟酸反应,所以是两性氧化物
⑨3mol单质Fe在氧气中完全转变为Fe3O4 , 失去8NA个电子
⑩用含硅胶、铁粉的透气小袋与食品一起密封包装,利用了Fe粉的还原性
(4)浓硝酸久置变黄
(5)明矾溶液与少量氢氧化钡溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13CNMR(核磁共振)、15NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获诺贝尔化学奖。下面有关叙述正确的是
A. 15N的核外电子数比中子数少1 B. 14N与14C互为同位素
C. 15N与14N为同一种核素 D. 13C与15N有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学的规角分析,下列说法不正确的是
A.锂离子电池是一种生活中常用的化学电源
B.纳米材料可用于制造不用洗的衣服面料
C.水中加入“催化剂”,可变成汽车燃料“油”
D.科学家未研发出只加水就能跑的“水氢发动机”汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A (g)+3B (g)![]() 2C (g)+2D (g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
2C (g)+2D (g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. υ (A)=0.05mol/(Ls) B. υ (B)=0.06mol/(Lmin)
C. υ (C)=0.04mol/(Ls) D. υ (D)=0.03mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+ . 将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
A.2.24g
B.3.36g
C.5.60g
D.10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A(g)+B(g)![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
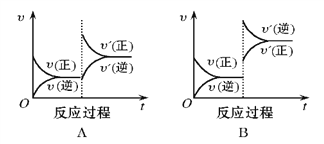
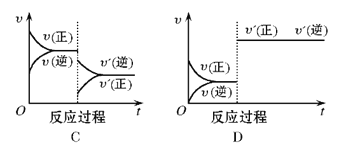
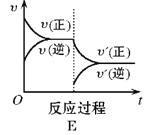
(1)升温,达到新平衡的是_________,新平衡中C的体积分数_________(填增大、减小或不变,下同) 。
(2)降压,达到新平衡的是__________,A的转化率__________。
(3)增加A的量,达到新平衡的是__________,此时B的转化率__________。
(4)使用催化剂,达到平衡的是__________, C的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
B.用过量氨水吸收工业尾气中的SO2:2NH3?H2O+SO2=2NH4++SO32﹣+H2O
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2C1﹣
Cu2++2C1﹣
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
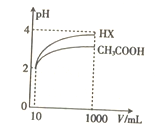
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com