
| A. | 同位素 | B. | 同分异构体 | C. | 同素异形体 | D. | 同种物质 |
科目:高中化学 来源: 题型:选择题
| A. | CH4和Cl2光照 | B. | 甲苯与液溴发生取代反应 | ||
| C. | CH2=CH-CH3与HCl加成产物 | D. | 乙烯和氯化氢加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
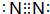 ,Z的原子结构示意图
,Z的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
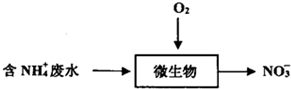
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+中含有的电子数为10NA | |
| B. | 1mol铁粉与1mol水蒸气充分反应转移的电子数为3A | |
| C. | 0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA | |
| D. | 电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
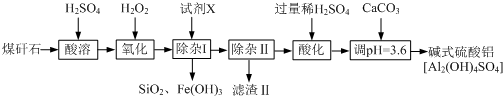
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: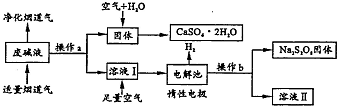
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com