
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
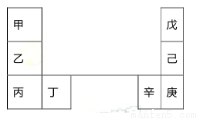
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙和庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
BC
【解析】
试题分析:戊的一种单质是自然界硬度最大的物质,所以戊是C元素;则己、庚分别是Si、Ge元素;甲和戊的原子序数相差3,所以甲是Li元素,则乙、丙分别是Na、K元素;则丁是Ca元素,辛是Ga元素。A、根据元素周期律,同主族元素的金属性从上到下逐渐增强,所以金属性:甲<乙<丙,错误;B、电子层数越多,原子半径越大,所以原子半径:辛>己>戊,正确;C、丙的原子序数是19,庚的原子序数是32,所以原子的核外电子数的差值也即原子序数的差值,丙与庚的原子核外电子数相差13,正确;D、Na在空气中燃烧生成过氧化钠,既含离子键又含共价键,错误,答案选BC。
考点:考查元素周期表、元素周期律、元素性质的结合应用


科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
下列有关物质水解的说法正确的是
A.蛋白质水解的最终产物是多肽 B.淀粉水解的最终产物是葡萄糖
C.纤维素不能水解成葡萄糖 D.油脂水解产物之一是甘油
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标Ⅱ卷解析版) 题型:填空题
[化学选修——3:物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
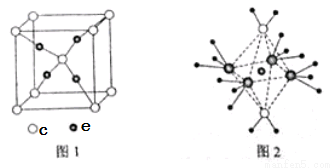
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:实验题
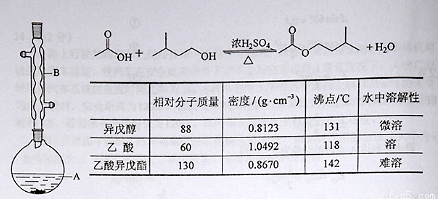
(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是: ; 第二次水洗的主要目的是: 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是:
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
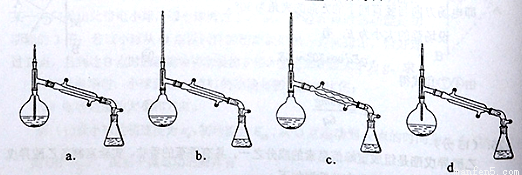
(7)本实验的产率是:
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:选择题
下列化合物中同分异构体数目最少的是( )
A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(广东卷解析版) 题型:填空题
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(山东卷解析版) 题型:填空题
(16分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(安徽卷解析版) 题型:选择题
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液,0.1000mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com