
| A、原电池的正极和电解池的阴极所发生的反应类型相同 |
| B、若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞试液,溶液仍无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况 |


科目:高中化学 来源: 题型:
| A、当金属全部溶解时收集到NO气体的体积为3.36L |
| B、当金属全部溶解时,无法计算参加反应的硝酸的物质的量 |
| C、将生成的沉淀加热灼烧,可能得到FeO、Fe2O3和CuO的混合物 |
| D、当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
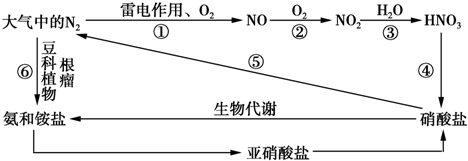
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
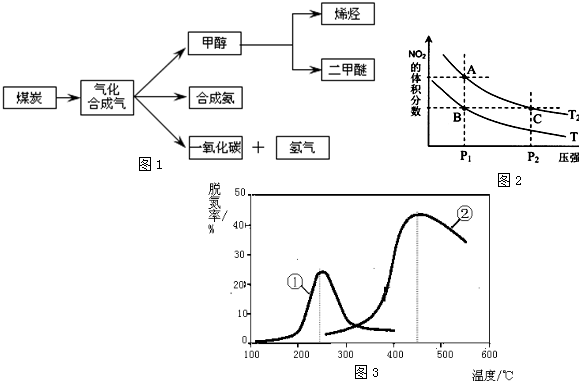
| [H2][CO] |
| [H2O] |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有Fe2+,一定没有Mg2+、Fe3+ |
| B、一定有Fe3+,一定没有Mg2+、Fe2+ |
| C、一定有Fe3+,可能有Fe2+,一定没有Mg2+ |
| D、一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
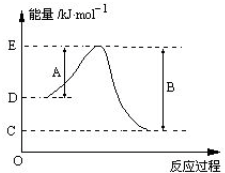
| 化学键 | H-H | Cl-Cl | I-I | O=O | C-Cl | C-H | O-H | H-Cl | H-I |
| kJ/mol | 436 | 247 | 151 | X | 330 | 413 | 463 | 431 | 299 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com