
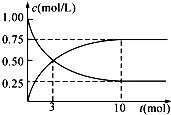
 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.| △c |
| △t |
| 0.75mol/L |
| 10min |
| c(H2O)?c(CH3OH) |
| c(CO2)?c3(H2) |
| c(H2O)?c(CH3OH) |
| c(CO2)?c3(H2) |


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量暗红色固体样品放在试管中,加入足量的锡氨水,震荡、静置 | ② | 假设3成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油是混合物,汽油是纯净物,油脂是纯净物 |
| B、蔗糖和麦芽糖水解的最终产物都是葡萄糖 |
| C、油脂是高级脂肪酸的甘油酯,可发生水解,有固定的熔点 |
| D、蛋白质是一种营养物质,可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2Br |
| B、BrCH2CH2CH2Br |
| C、CH3CHBrCH2Br |
| D、CH3CHBrCH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL O.1 mol?L-1NH4C1溶液与5 mL、0.2 mol?L-1NaOH溶液混合:c(Na+)=c(C1-)>c(OH-)>c(NH4+)>c(H+) |
| B、0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+)>c(HB-) c(H2B)>c(B2-) |
| C、常温时,NaHC03溶液中:c(Na+)=c(HC03-)+c(H2 CO3) |
| D、相同条件下,pH=5的①NH4C1溶液、②CH3COOH溶液、③稀盐酸中由水电离出的c(H+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳 | B、氢氧化钠固体 |
| C、NaCl晶体 | D、氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com