
| A. | 1mol奥沙拉嗪( ) 与足量Na2CO3溶液反应能生成4molC O2B ) 与足量Na2CO3溶液反应能生成4molC O2B | |
| B. | 已知反应mX(g)+nY(g)?qZ(g),若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1 | |
| C. | 1L 1mol/LNa2CO3溶液中含有3×6.02×1023个离子 | |
| D. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol•L-1和是1.0×10-bmol•L-1,在此温度时,水的离子积为1.0×10-(b+a) |
分析 A、酚羟基(与碳酸钠反应生成碳酸氢钠)、羧基都与碳酸钠反应;
B、由反应可知,若平衡时X、Y的转化率相等,则反应开始时X、Y的物质的量之比应为m:n;
C、碳酸钠是强碱弱酸盐,碳酸根离子水解;
D、根据Kw=c(H+)×c(OH-)计算.
解答 解:A、酚羟基(与碳酸钠反应生成碳酸氢钠)、羧基都与碳酸钠反应,所以1mol奥沙拉嗪( ) 与足量Na2CO3溶液反应能生成2molC O2,故A错误;
) 与足量Na2CO3溶液反应能生成2molC O2,故A错误;
B、由反应可知,若平衡时X、Y的转化率相等,则反应开始时X、Y的物质的量之比应为m:n,所以反应开始时X、Y的物质的量之比不一定为1:1,故B错误;
C、碳酸钠是强碱弱酸盐,碳酸根离子水解,所以1L 1mol/LNa2CO3溶液中含有离子数大于3×6.02×1023个,故C错误;
D、硫酸中水电离出来的c(H+)=c(OH-)=1.0×10-amol/L,硫酸铁溶液中水电离出来的c(H+)是1.0×10-bmol/L,则硫酸中c(H+)是1.0×10-bmol/L,则Kw=c(H+)×c(OH-)=1.0×10-a×1.0×10-b=1.0×10-(a+b),故D正确.
故选D.
点评 本题考查较为综合,题目难度中等,易错点为C,注意碳酸根离子的水解1mol碳酸根水解生成2mol的离子,同时D把握水的离子积的计算.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
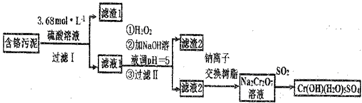
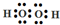 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| B. | 可用25mL碱式滴定管量取20.00 mLKMnO4溶液 | |
| C. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 | |
| D. | 向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液除去乙酸乙酯中的少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 页岩气是一种新型的能源,主要成分是甲烷和少量液态烃及CO2,使用页岩气可以有效地降低碳排放量,减少温室效应 | |
| B. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 | |
| C. | 李比希基团理论、逆合成分析理论、范特霍夫对有机化合物结构的三维认识都为有机化学的发展作出贡献 | |
| D. | 石油加工工艺除常见的裂化外,还有催化重整和加氢裂化等工艺,它们都是为了提高汽油等轻质油品质;催化重整还是获得芳香烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
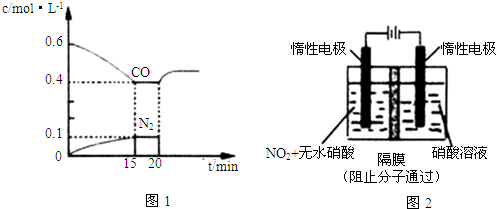
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
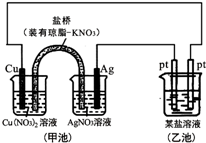
| A. | 图中甲池为原电池装置,电子从铜电极通过溶液和盐桥流向Ag电极 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变 | |
| D. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液不可能是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过红外光谱分析可以区分乙醇和乙酸 | |
| B. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| D. | 石油的裂解、煤的干馏、蛋白质的盐析和淀粉的水解都是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com