
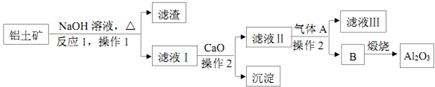


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Zn2++2OH-═Zn(OH)2↓ ZnCO3+2NaOH═Zn(OH)2↓+Na2CO3 |
| B、Ag++Cl-═AgCl↓ AgNO3+NaCl═AgCl↓+NaNO3 |
| C、Ba2++SO42-═BaSO4↓ Ba(OH)2+CuSO4═BaSO4↓+Cu(OH)2↓ |
| D、Cu+2Ag+═Cu2++2Ag↓ Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白烟的成分为NH4Cl晶体颗粒 |
| B、该反应属于复分解反应 |
| C、该反应利用了Cl2的强氧化性 |
| D、生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
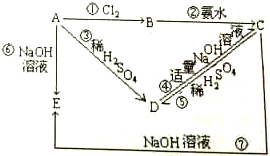 已知A为金属单质,根据如图物质的变化,回答:
已知A为金属单质,根据如图物质的变化,回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
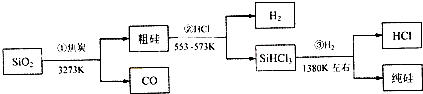
| A、①②③均属于氧化还原反应 |
| B、H2和HCl均可循环利用 |
| C、SiO2是一种坚硬难熔的固体 |
| D、光纤的主要成分是高纯度的单质硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com