
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
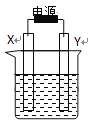
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO
②单位时间内生成n molO2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是:①试管夹、②镊子、③小刀、④滤纸、⑤研钵、⑥烧杯、⑦坩埚、⑧石棉网、⑨玻璃片、⑩药匙.
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)①与氧同周期的相邻元素及氧的第一电离能由大到小的顺序为________________。
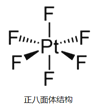
②已知:离子型配位化合物O2[PtF6]中铂元素为+ 5价,它可由反应PtF6+O2= O2[PtF6]制得,PtF6分子结构如图所示。PtF6分子中Pt的杂化轨道类型是否为sp3?答:_____(填“是”或“否”),其原因是_______。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构简式为![]() )。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
)。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____(填字母)。
A.中心原子的价层电子对数目相等
B.都是极性分子
C.中心原子的孤对电子数目相等
D.都含有极性键
②SO3子的空间构型为________,与其互为等电子体的阴离子为_____(举一例)。
(4)元素X与硒同周期,且该周期中X元素原子核外未成对电子数最多,则X为____基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体,其晶胞为简单立方;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_____g·cm-3(只列表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关。
(1)氮原子最外层电子排布式为:_________;氮离子![]() 核外有___种运动状态不同的电子;N4分子的空间结构如图:
核外有___种运动状态不同的电子;N4分子的空间结构如图:![]() ,它是一种_____分子。(填“极性”或“非极性”)
,它是一种_____分子。(填“极性”或“非极性”)
(2)氨气是人工固氮的产物,它极易溶于水(![]() ),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性。则该溶液中NH3 · H2O、![]() 、
、![]() 三种微粒的物质的量浓度大小关系为____________。
三种微粒的物质的量浓度大小关系为____________。
(4)铵盐可用作氮肥,实验室检验铵盐中的![]() 时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有
时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有![]() 。
。
(5)NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2。请写出该反应的化学方程式_______________________,每生成3mol N2时,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,下图是利用一种微生物将废水中的尿素[CO(NH2)2]转化为对环境无害物质的装置。下列叙述错误的是

A. M电极有CO2和N2生成
B. H+透过质子交换膜由左向右移动
C. 微生物促进了反应中电子的转移
D. N电极反应式为O2 + 2H2O + 4e﹣= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com