
| A. | .②③ | B. | .②④ | C. | ①②③ | D. | .①③④ |
分析 ①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物;
②电解质在水溶液中完全电离,而弱电解质电离不完全;
③根据分散系分散质微粒大小将分散系分为溶液、胶体和浊液;
④根据水溶液或是熔融态是否能够导电将化合物分为电解质和非电解质.
解答 解:①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,不是组成元素,故①错误;
②电解质在水溶液中完全电离,而弱电解质电离不完全,根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质,故②正确;
③根据分散系分散质微粒大小将分散系分为溶液、胶体和浊液,故③错误;
④根据水溶液或熔融态是否能够导电将化合物分为电解质和非电解质,故④错误;
故选D.
点评 本题考查物质的分类,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
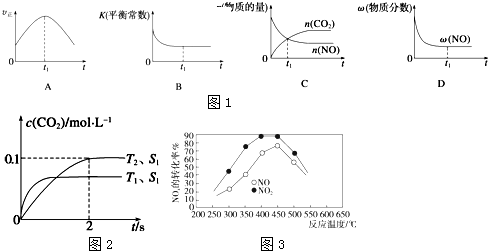
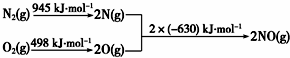
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.
在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com