

分析 (1)某固体甲[成分为M3Z2(OH)a(CO3)b]可用作塑料阻燃剂,该盐分解产生大量的CO2可以作为原料制备有机产品,取甲46g高温灼烧至恒重,得到11.2L CO2(标准状况),二氧化碳物质的量n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,生成22.2g仅含两种金属氧化物的固体乙,其中Z的氧化物既溶于强酸又溶于强碱说明为Al2O3,向乙中加入足量的稀硫酸所得产物中含有MSO4,M为+2价金属,反应生成水的质量=46g-22.2g-0.5mol×44g/mol=1.8g,n(H2O)=0.1mol,化学式中得到$\frac{a}{2}$:b=0.1:0.5,得到a:b=2:5则a=2,b=5,依据化合物中 元素化合价代数和为0计算,M3Z2(OH)2(CO3)5 中M为+2价,Z为+3价,则Z为Al,化合物摩尔质量M=$\frac{46g}{0.1mol}$=460g/mol,460-388=72,计算得到M摩尔质量=$\frac{72}{3}$g/mol=24g/mol,则M为Mg,判断得到金属氧化物为氧化镁、氧化铝,还生成二氧化碳和水,结合原子守恒配平书写化学方程式;
(2)依据甲分解过程吸热和产物的性质分析,二氧化碳不助燃,生成的氧化镁、氧化铝都是熔点高的耐火材料;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式,3×②-2×①-6×③得到;
(4)反应CO2(g)+3H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH3OH(g)+H2O(g),
A.反应物起始的物质的量之比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5或$\frac{n({H}_{2})}{n(C{O}_{2})}$=2,同温度下,氢气越多二氧化碳转化率越大,则曲线Ⅰ对应的反应物起始物质的量之比为2,故A错误;
B.单位时间内消耗H2的物质的量与消耗H2O的物质的量之比为3:1时,正逆反应速率相同;
C.曲线Ⅰ对应的反应物起始物质的量之比为2,图象可知a点对应的CO2的平衡转化率为60%,二氧化碳和氢气转化率之比等于1:3;
D.温度升高二氧化碳平衡转化率减小,说明升温平衡逆向进行,正反应为放热反应,b点温度高对应的平衡常数K值小于c点;
(5)在体积为2L的固定绝热的密闭容器中加入1 molCH3OH和1 molH2O,第4 min达到平衡,反应中c(CO2)的变化情况如图2所示,说明是逆反应达到的化学平衡状态,在第5 min时向体系中再充入0.2molCO2和0.4molH2(其它条件不变),平衡正向进行二氧化碳浓度减小,第8 min达到平衡,此时c(H2)=c(CH3OH),据此画出图象.
解答 解:(1)某固体甲[成分为M3Z2(OH)a(CO3)b]可用作塑料阻燃剂,该盐分解产生大量的CO2可以作为原料制备有机产品,取甲46g高温灼烧至恒重,得到11.2L CO2(标准状况),二氧化碳物质的量n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,生成22.2g仅含两种金属氧化物的固体乙,其中Z的氧化物既溶于强酸又溶于强碱说明为Al2O3,向乙中加入足量的稀硫酸所得产物中含有MSO4,M为+2价金属,反应生成水的质量=46g-22.2g-0.5mol×44g/mol=1.8g,n(H2O)=0.1mol,化学式中得到$\frac{a}{2}$:b=0.1:0.5,得到a:b=2:5则a=2,b=5,依据化合物中 元素化合价代数和为0计算,M3Z2(OH)2(CO3)5 中M为+2价,Z为+3价,则Z为Al,化合物摩尔质量M=$\frac{46g}{0.1mol}$=460g/mol,460-388=72,计算得到M摩尔质量=$\frac{72}{3}$g/mol=24g/mol,则M为Mg,判断得到金属氧化物为氧化镁、氧化铝,还生成二氧化碳和水,结合原子守恒配平书写化学方程式:Mg3Al2(OH)2(CO3)5 $\frac{\underline{\;高温\;}}{\;}$3MgO+Al2O3+5 CO2↑+H2O↑,
故答案为:Mg3Al2(OH)2(CO3)5 $\frac{\underline{\;高温\;}}{\;}$3MgO+Al2O3+5 CO2↑+H2O↑;
(2)依据甲分解产物的性质分析,二氧化碳不助燃,生成的氧化镁、氧化铝都是熔点高的耐火材料,甲能用作塑料阻燃剂的原因;甲分解吸热且产生大量二氧化碳,同时还生成耐高温的MgO和Al2O3覆盖在塑料表面,
故答案为:甲分解吸热且产生大量二氧化碳,同时还生成耐高温的MgO和Al2O3覆盖在塑料表面;
(3)①CO2(g)+3H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH3OH(g)+H2O(g)△H1
②2H2(g)+O2(g)═2H2O(1)△H2
③H2O(g)═H2O(1)△H3
依据盖斯定律计算3×②-2×①-6×③得到气态甲醇完全燃烧生成CO2(g)和气态水的热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=3△H2-2△H1-6△H3,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=3△H2-2△H1-6△H3;
(4)反应CO2(g)+3H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH3OH(g)+H2O(g),
A.反应物起始的物质的量之比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5或$\frac{n({H}_{2})}{n(C{O}_{2})}$=2,同温度下,氢气越多二氧化碳转化率越大,则曲线Ⅰ对应的反应物起始物质的量之比为2,故A错误;
B.单位时间内消耗H2的物质的量与消耗H2O的物质的量之比为3:1时,正逆反应速率相同,反应达到平衡状态,故B正确;
C.曲线Ⅰ对应的反应物起始物质的量之比为2,图象可知a点对应的CO2的平衡转化率为60%,二氧化碳和氢气转化率之比等于1:3,则氢气转化率=$\frac{3}{2}$×60%=90%,故C正确;
D.温度升高二氧化碳平衡转化率减小,说明升温平衡逆向进行,正反应为放热反应,b点温度高对应的平衡常数K值小于c点,故D错误;
故答案为:BC;
(5)在体积为2L的固定绝热的密闭容器中加入1 molCH3OH和1 molH2O,第4 min达到平衡,反应中c(CO2)的变化情况如图2所示,说明是逆反应达到的化学平衡状态,在第5 min时向体系中再充入0.2molCO2和0.4molH2(其它条件不变),平衡正向进行二氧化碳浓度减小,第8 min达到平衡,此时c(H2)=c(CH3OH),0.2起点,0.175平衡点,据此画出图象为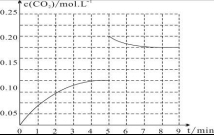 ,
,
答:5到9 min的c(CO2)浓度示意曲线 .
.
点评 本题考查了物质组成和含量的测定、物质组成的计算应用、热化学方程式书写、化学反应速率和平衡的影响因素判断,主要是图象的理解和绘制,掌握基础是解题关键,题目难度较大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
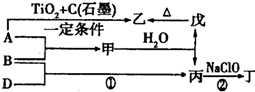
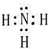 ,丁中所包含的化学键类型有bc(填字母序号).
,丁中所包含的化学键类型有bc(填字母序号).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,锂铝合金作负极,Li+向负极移动 | |
| B. | 充电时,阴极的电极反应式为:Fe+2Li2S-4e-=4Li++FeS2 | |
| C. | 该电池可用LiCl水溶液作电解质溶液 | |
| D. | 以Al作阳极,FeS为阴极,LiCl-KCl低共熔混合物为电解质进行电解,可以制得FeS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
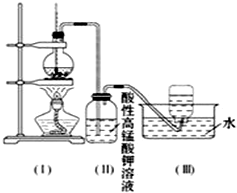 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+ | |
| B. | Fe2++NH3•H2O+HCO3-═FeCO3↓+NH4++H20 | |
| C. | Fe2++2HCO3-═Fe(OH)2↓+2CO2↑ | |
| D. | 2Fe2++HCO3-+3NH3•H2O═Fe2(OH)2CO3↓+3NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E | F | G | H |
| 原子半径/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| 最高化合价 | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| 最低化合价 | -3 | -2 | -2 | -1 |
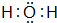 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是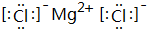 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com