
【题目】下图所示装置是化学实验室的常用装置,它有多种用途.以下各项用途和操作都正确的是
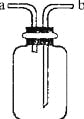
(已知:2H2S+SO2=3S+2H2O)
A.干燥CO2:瓶内放一定体积浓硫酸,由a进气
B.用于收集O2:瓶内充满水,由b进气
C.提供少量CO:瓶内充满CO,b接进水管
D.用做H2S和SO2反应的装置:由a通入H2S,b通入SO2
科目:高中化学 来源: 题型:
【题目】类比法是一种常用的化学思维,下列各项中类比结论正确的是
选项 | 已知 | 类比结论 |
A | 强碱弱酸盐 |
|
B |
|
|
C | 用惰性电极电解熔融的 | 用惰性电极电解熔融的 |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/ kJmol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)![]() N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。

(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室中将某工厂废弃的一块合金,经过一系列的反应,制得氧化铝固体、硝酸铜晶体和铁红。其实验方案如下图。

(1)该小组所用的合金中含有的金属为铁、______、______(填名称)。
(2) 操作①、③使用的主要玻璃仪器是___________,操作②的方法:________。操作④实验操作步骤包括:______、_______(填操作名称)、过滤、洗涤、干燥。
(3)写出滤渣B中较活泼金属与足量稀硝酸发生反应的离子方程式:_______。
(4)若该小组通过上述实验流程制得铁红16g,假设实验过程中无质量损失,则合金中铁的质量为________g。
(5)上述实验流程中符合“绿色化学“理念的做法是___________(答出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:

(1)铜为___极,导线中电子流向为___(用a、b表示)。
(2)若装置中铜电极的质量增加3.2g,则导线中转移的电子数目为___;(用若NA表示阿伏加德罗常数,“NA”表示)
(3)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是___。
A.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
B.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
C.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3+ +Cu=2Fe2+ +Cu2+设计成原电池,其正极反应是___。
(5)设计一个电化学装置,实现这个反应:Cu+H2SO4=CuSO4+H2↑,请在下面方框内画出这个电化学装置图。___

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B. NH4Cl溶于D2O中:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
C. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1molL-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
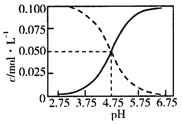
A.25℃时,CH3COOH的电离常数K的值5×10-2.75
B.随pH增大,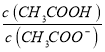 增大
增大
C.pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com