
分析 (1)①实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体,是强酸制弱酸,复分解反应;
②硫化氢燃烧生成有毒的气体,污染大气;
(2)①由反应方程式可知:2FeCl3+H2S=S↓+2FeCl2+2HCl,硫的化合价升高,硫化氢是还原剂;
②KSCN溶液检验铁离子的存在;
(3)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
解答 解:(1)①实验室用硫化亚铁固体与稀硫酸反应来制备H2S气体,是强酸制弱酸的复分解反应,方程式为FeS+H2SO4=FeSO4+H2S↑,
故答案为:FeS+H2SO4=FeSO4+H2S↑;
②硫化氢燃烧生成有毒的气体,污染大气,故答案为:H2S燃烧时产生SO2,污染环境;
(2)①由反应方程式可知:2FeCl3+H2S=S↓+2FeCl2+2HCl,硫的化合价升高,硫化氢是还原剂,故选:d;
②KSCN溶液检验铁离子的存在,故答案为:KSCN溶液;
(3)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀,故答案为:加入电解质,使胶体凝聚;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色,故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深,
故答案为:有I2生成;2Fe3++2I-═I2+2Fe2+.
点评 本题考查硫化氢的制法和性质,硫化氢中硫是-2价最低价态,具有还原性,了解胶体的制备及性质是解题关键,比较容易.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25ml的碱式滴定管量取14.80mlNaOH溶液 | |
| B. | 用100ml量筒量取5.2ml的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用100ml容量瓶配制50ml1.0mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
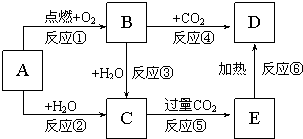 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁矿石在高温下被氧化成铁 | B. | 生铁中杂质被氧化 | ||
| C. | 铁矿石在高温下被焦炭还原成铁 | D. | 铁矿石在高温下被CO还原成铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 生石灰能与水反应,可用来干燥氯气 | |
| D. | 氯化铝是由金属元素和非金属元素组成的化合物,属于离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com