
| A. | 高铁酸钾处理水的原理与明矾完全相同 | |
| B. | 推广煤的气化和液化技术,能减少二氧化碳的排放 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料 | |
| D. | 食品安全包括限制添加剂的种类和添加的量 |
分析 A.高铁酸钾具有强氧化性,明矾水解生成胶体可净化水;
B.煤的气化生成CO和氢气,液化生成甲醇,提高能源利用率;
C.特种钢缆为金属材料;
D.食品安全剂应限量使用,过量对人体有害.
解答 解:A.高铁酸钾具有强氧化性可杀菌消毒,明矾水解生成胶体可净化水,二者原理不同,故A错误;
B.煤的气化生成CO和氢气,液化生成甲醇,提高能源利用率,由C原子守恒可知不能减少二氧化碳的排放,故B错误;
C.特种钢缆为金属材料,不是非金属材料,故C错误;
D.食品安全剂应限量使用,过量对人体有害,则食品安全包括限制添加剂的种类和添加的量,要严格控制,故D正确;
故选D.
点评 本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

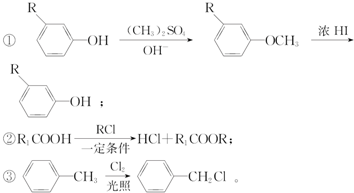
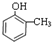 .
.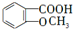 +
+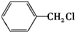 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$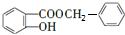 +HCl.
+HCl.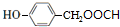 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
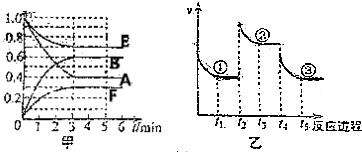
| A. | t2时刻可能是增大压强 | |
| B. | 平衡状态①和②,平衡常数K一定相同 | |
| C. | 平衡状态①、②和③中,状态③中F的浓度最大 | |
| D. | t4时刻改变的条件是降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
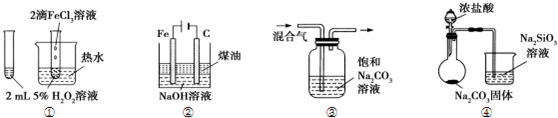
| A. | ①验证FeCl3对H2O2分解反应有催化作用 | |
| B. | ②制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | ③除去CO2气体中混有的SO2 | |
| D. | ④比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
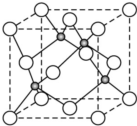 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
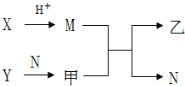 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | 相对分子质量M>N,沸点N>M | |
| B. | A、C、D的常见氧化物相互之间一定能反应 | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com