
下列说法正确的是 ( )
A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,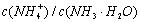 的比值增大
的比值增大
D、室温下,CH3COOH的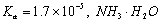 的
的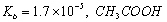 溶液中的c (H+)与NH3·H2O中的c(OH-)相等
溶液中的c (H+)与NH3·H2O中的c(OH-)相等
【知识点】溶液中的平衡、离子浓度关系
【答案解析】C 解析:A、水的离子积KW只与温度有关,外加酸、碱一定会影响水的电离程度,但盐不一定,如NaCl,故A错误;B、Ksp只与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误; C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,铵根水解呈酸性,能使溶液的pH减小, c (NH4+)/ c (NH3·H2O)=Kb/C(OH-),C(OH-)减小,比值增大,故C正确;D、电离常数表达式:Ka= c (H+)·C(CH3COO-)/ c (CH3COOH),Kb= c (NH4+)·C(OH-)/ c (NH3·H2O),不知酸碱浓度是否相等,故D错误。
故答案选C
【思路点拨】本题考查较为综合,涉及电离常数的定性判断和计算、弱电解质的电离、盐类
的水解等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
根据下列物质的化学性质,判断其应用错误的是( )
|
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 |
|
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 |
|
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
|
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g) + B(g)=3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
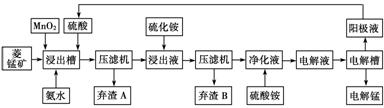
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(结构如下图)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是
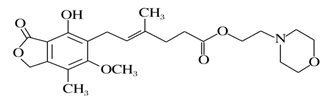
A. 霉酚酸酯能溶于水
B. 霉酚酸酯能与浓溴水发生取代反应
C. 1 mol霉酚酸酯能与含4 mol NaOH的水溶液完全反应
D. 霉酚酸酯既可以催化加氢,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:①乙酸乙酯和碳酸钠溶液 ②乙醇和水
③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A分液、萃取、蒸馏 B萃取、蒸馏、分液
C分液、蒸馏、萃取 D蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④
C.①② D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com