
【题目】某溶液中仅含有一种溶质,若在该溶液中加入BaCl2溶液出现白色沉淀再加稀HNO3沉淀不消失,则该溶液不可能含有的溶质是( )
A.AgNO3
B.CuSO4
C.K2SO3
D.Na2CO3
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正
 确的是
确的是
A. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
B. 阿斯巴甜分子中有2个手性碳原子
C. 分子式为:C14H18N2O5,阿斯巴甜属于蛋白质
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值.下列叙述正确的是
A. 常温常压下,46g的NO2和N2O4混合气体含有的分子数为NA
B. 常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA
C. 标准状况下,1L乙醇完全燃烧产生![]() 分子的数目为
分子的数目为![]()
D. 1molCH3+中含有电子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污
泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为__________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式______________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是____(选填编号),滴定终点现象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
一元取代苯进行苯环上的取代反应时,原有的基团对后进入基团在苯环上的位置有定位效应。如若原有基团为-CH3、-OH、-X(卤素原子)时新进入基团在其邻、对位; 若原有基团为-NO2、-CHO、-COOH时新进入基团在其间位。
2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:

已知: (弱碱性,易被氧化)
(弱碱性,易被氧化)
回答下列问题:
(1)反应①的类型是_____________,反应⑧所需的试剂和条件是_____________________。
(2)F中的非含氧官能团的名称是______________________。
(3)C的结构简式是_______________;B的所有同分异构体中满足下列条件的有_______种:
①能与NaOH溶液反应
②含有苯环且苯环上连有氨基(-NH2)
(4)写出⑥的化学反应方程式:_____________________________________________,该步反应的主要目的是______________________________。
(5)参照上述合成路线及信息,写出以苯为原料合成邻硝基苯酚(  )的合成路线(注明反应试剂和条件,无机试剂任选) ______________。
)的合成路线(注明反应试剂和条件,无机试剂任选) ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为
![]()
下列说法中不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯的一氯取代物有3种
C. 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2
D. 对三联苯分子中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛与铁是很重要的金属。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为__________________,金属钛晶胞如下左图所示,晶胞参数为a=b= 295.08pm,c=468.55pm,α=β=90%,y= 120%。金属钛为______________堆积(填堆积方式)。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为____________晶 体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因:_______________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为_________________。
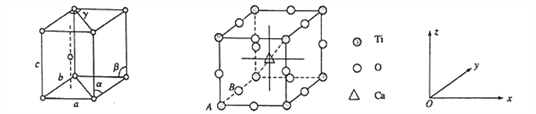
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为______________。
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为_______________________。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为________g/cm3(列出算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com