
25℃时,将1mol下列各物质加入适量水配成1 L溶液:①H2SO4,②H3PO4,③CH3COOH,④CaCO3,则各溶液的导电能力由强到弱的顺序应是
[ ]
|
【巧解导析】H2SO4,CaCO3为强电解质,而H3PO4,CH3COOH为弱电解质;H2SO4,H3PO4,CH3COOH易溶于水,而CaCO3难溶于水;H3PO4与CH3COOH相比,CH3COOH是更弱的电解质.它们的电离方程式如下: H2SO4 H3PO4 CH3COOH CaCO3 电解质溶液的导电能力取决于溶液中自由移动的离子的浓度,CaCO3虽然是强电解质,但由于CaCO3难溶于水,故CaCO3溶液中Ca2+, |
|
【巧解点悟】解题关键点是弄清电解质溶液导电能力强弱的原因:自由移动离子浓度的大小.解题易错点:认为强电解质溶液的导电能力强,而弱电解质溶液的导电能力就一定弱而易错选B. |


科目:高中化学 来源: 题型:
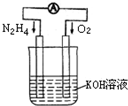 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com