
 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.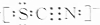 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.分析 (1)Co原子核外电子数为27,根据能量最低原理书写核外电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(3)①H2O中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为4;
②单键为σ 键,三键含有1个σ 键、2个π键;
③原子总数相等、价电子总数也相等的微粒互为等电子体;
(4)氨气分子之间形成氢键,沸点高于甲烷的;
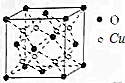
(5)根据均摊法计算晶胞中O原子、Cu原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)Co原子核外电子数为27,根据能量最低原理,其核外电子排布式为1s22s22p63s23p63d74s2,
故答案为:1s22s22p63s23p63d74s2;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,
故答案为:N>O>C;
(3)①H2O中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为,氧原子采取sp3杂化,
故答案为:sp3;
②SCN-的电子式为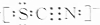 ,单键为σ 键,三键含有1个σ 键、2个π键,则SCN-中σ 键与π键的个数比为2:2=1:1,
,单键为σ 键,三键含有1个σ 键、2个π键,则SCN-中σ 键与π键的个数比为2:2=1:1,
故答案为:1:1;
③原子总数相等、价电子总数也相等的微粒互为等电子体,一种与CO为等电子体的分子的化学式为N2,
故答案为:N2;
(4)氨气分子之间形成氢键,甲烷分子之间为范德华力,氢键比范德华力更强,故氨气的沸点高于甲烷的,
故答案为:NH3;氨气分子之间形成氢键,甲烷分子之间为范德华力;
(5)晶胞中Cu原子数目为8、O原子数目8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{8×64+16×4}{{N}_{A}}$g,晶体密度=$\frac{8×64+16×4}{{N}_{A}}$g÷(a cm)3=$\frac{576}{{N}_{A}×{a}^{3}}$g/cm3,
故答案为:$\frac{576}{{N}_{A}×{a}^{3}}$g/cm3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式判断、化学键、等电子体、氢键、晶胞计算等,注意理解掌握同周期元素第一电离能异常情况.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
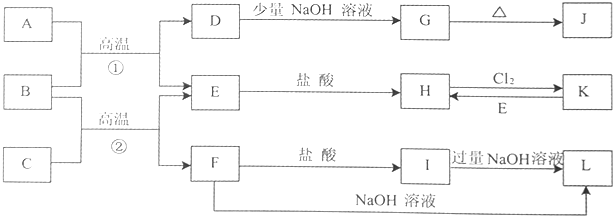
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加金属钠看是否有氢气放出 | |
| B. | 与新制的氢氧化铜悬浊液混合后共热,观察是否有红色沉淀 | |
| C. | 与醋酸和浓H2SO4共热,观察是否有果香味物质生成 | |
| D. | 加入酸性KMnO4溶液,看溶液是否褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
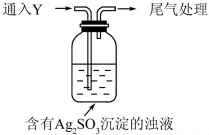 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用溴水和苯在催化剂作用下制溴苯: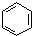 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$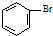 +HBr +HBr | |
| B. | 乙酸乙酯和H${\;}_{2}^{18}$O发生酸性水解反应:CH3COOC2H5+H-18OH $?_{△}^{酸}$CH3CO18OH+C2H5OH | |
| C. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2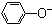 +CO2+H2O→ +CO2+H2O→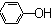 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com