
【题目】某温度下, pH值相同的盐酸和醋酸溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是

A.曲线Ⅰ为醋酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度大
C.a点时,加入相同大小的锌粒,与盐酸反应的速率大
D.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
科目:高中化学 来源: 题型:
【题目】根据要求填空(所涉及元素均为前20号)
(1)A元素的原子M层有5个电子,则其原子结构示意图为__________________;最高价氯化物的化学式_______________________。
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,请写出C离子的结构示意图和电子式:________________、_________。
(3)标出下列反应的电子转移方向和数目,并填写有关内容:
KClO3+6HCl→3Cl2↑+3H2O+KCl、___________
氧化剂______________;氧化产物______________;还原剂______________;还原产物______________;被氧化的元素______________;HCl的作用______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热可以制取Fe(OH)3胶体。试回答下列问题:
①写出此过程中的化学方程式:__;
②向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,继续滴加,沉淀最终消失且得棕黄色溶液,写出相关的离子方程式___;
(2)鸡蛋的内膜是一种半透膜,某同学拟用这种半透膜进行除去淀粉溶液中所含食盐的实验。设计步骤如下:
a.把鸡蛋的一头敲破,倒出蛋清、蛋黄,洗净蛋膜内部,将另一头浸泡在稀酸中溶去部分蛋壳(中间的蛋壳留着,起固定作用);
b.在一只小烧杯中加入适量蒸馏水,将洗净了蛋膜外部的蛋壳架在小烧杯上,蛋膜浸入蒸馏水中(如图);
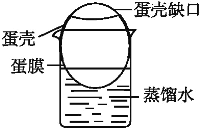
c.向蛋膜内加入淀粉和食盐的混合溶液,静置一段时间;
d.拿走蛋膜,检验烧杯中有无淀粉和食盐。
根据以上叙述,回答下列问题:
①步骤a中溶解蛋壳(主要成分为CaCO3)的酸最好是_____(填“盐酸”“硫酸”或“醋酸”)。
②检验烧杯中有无淀粉,操作是_____,检验烧杯中有无NaCl,操作是_____。
③为尽可能除去淀粉溶液里的食盐,可采取的措施是______(填入正确选项前的字母)。
A.换大烧杯,用大量水进行渗析
B.多次渗析,每次用水量不要太多
C.将蛋膜放在有流水的水槽中进行渗析
④如何证明淀粉溶液中的食盐有没有全部除去?简述实验过程:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究水样中污染物X在不同影响因素下的分解速率,测得X的物质的量浓度(![]() )随时间(min)变化的实验数据如下:
)随时间(min)变化的实验数据如下:
温度 | 时间 浓度 水样 | 0 | 10 | 20 | 30 | 40 |
| I | 0.80 | 0.68 | 0.60 | 0.56 | 0.54 |
| II | 1.60 | 1.34 | 1.20 | 1.08 | 1.02 |
| III | 1.60 | 1.26 | 1.08 | 0.94 | 0.94 |
下列说法不正确的是
A. ![]() 温度下水样I中,
温度下水样I中,![]() 之间X分解的平均反应速率为
之间X分解的平均反应速率为![]()
B. ![]() 温度下水样Ⅱ中,
温度下水样Ⅱ中,![]() 时X的浓度小于
时X的浓度小于![]()
C. ![]() 温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为
温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为![]()
D. 由表中数据推测,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法正确的是( )
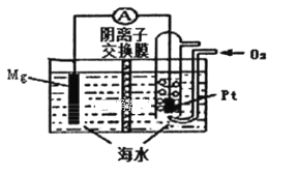
A. 通入氧气的电极为负极
B. 电池工作时,溶液中的Na+由负极移向正极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为体积224ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图:
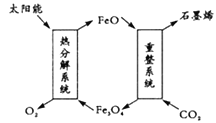
则重整系统发生反应的化学方程式为_________。

(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将________(填“增大”、“ 减小”或“不变”);
②△H_____0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 _____H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
CO2(g)+H2O(l)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(l) △H3=ckJ/mol
HCO3-(aq)+H2O(l) △H3=ckJ/mol
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为______________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5kJ/mol |
Ka1(H2CO3) | 4×10-7kJ/mol |
Ka2(H2CO3) | 4×10-11kJ/mol |
则反应NH4++HCO3-+H2O![]() NH3 H2O+H2CO3的平衡常数K=___________。
NH3 H2O+H2CO3的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
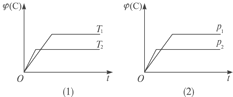
下列叙述正确的是()
A. 平衡后,若使用催化剂,C的体积分数增大
B. 平衡后,若温度升高,化学平衡向正反应方向移动
C. 化学方程式中,化学计量数的关系为n<e+f
D. 平衡后,增加A的质量,化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,17g 甲基(-14CH3)所含的中子数为 9 NA
B. 电解精炼铜的过程中,若阳极减轻 64 g,则电路中一定通过 2NA 个电子
C. NA 个 Fe(OH)3 胶体粒子的质量为 107 g
D. 1mol 铜与足量硫蒸气反应,转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离提纯的方法不正确的是( )
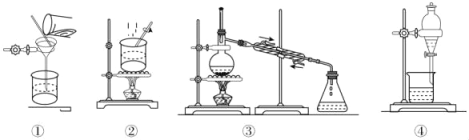
A. 提纯工业乙醇(含甲醇、水等杂质)的装置:③
B. 提纯粗苯甲酸选择装置:②①
C. 提纯粗苯甲酸三个步骤:加热溶解、趁热过滤、冷却结晶
D. 苯中混有少量苯酚选择装置:④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com