
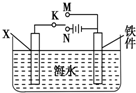
 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.分析 (1)铁锈的成分为Fe2O3,能和酸反应生成盐和水;
(2)若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
若X为锌,开关K置于M处,Zn为阳极被腐蚀,Fe为阴极被保护;
(3)图中若X为粗铜,此装置为电镀装置,即在铁件上镀铜,据阴极反应来分析转移电子情况;如果铁件部分未镀上铜,会在潮湿的环境中形成原电池,铁做负极.
解答 解:(1)铁锈的成分为Fe2O3,能和酸反应生成盐和水,;离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极即连接电源的负极,故K连接N处,故答案为:N;
②若X为锌,开关K置于M处,Zn为阳极被腐蚀,Fe为阴极被保护,该防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法;
(3)图中若X为粗铜,此装置为电镀装置,即在铁件上镀铜,阴极反应:Cu2++2e-=Cu,铁件质量增加3.2g即为铜的质量,即增加铜的物质的量n=$\frac{m}{M}$=$\frac{3.2g}{64g/mol}$=0.05mol,根据阴极反应可知,当阴极上有0.05mol铜析出时,转移0.1mol电子即0.1NA个;如果铁件部分未镀上铜,会在潮湿的环境中形成原电池,铁做负极,加快铁的腐蚀,故答案为:0.1,在潮湿的环境中形成原电池.
点评 本题考查了原电池和电解池原理,根据原电池中正负极上得失电子及电极反应式来分析解答即可,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.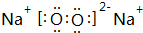 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在2010年12月初农兴中学顺利接受省级示范高中验收期间,学校租用了大量盆栽鲜花装扮校园.为保证鲜花盛开,这些盆栽鲜花都施用了S-诱抗素剂,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
在2010年12月初农兴中学顺利接受省级示范高中验收期间,学校租用了大量盆栽鲜花装扮校园.为保证鲜花盛开,这些盆栽鲜花都施用了S-诱抗素剂,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | S-诱抗素含有苯环、羟基、羰基、羧基 | |
| B. | S-诱抗素能与NaHCO3反应放出CO2 | |
| C. | S-诱抗素的分子式为C14H20O4 | |
| D. | 1molS-诱抗素在一定条件下可分别与4molH2、2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
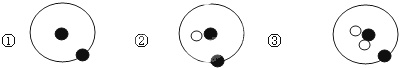
| A. | ①、②、③互为同位素 | B. | ①、②、③互为同素异形体 | ||
| C. | ①、②、③是三种化学性质不同的核素 | D. | ①、②、③质量数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 | |
| B. | N2,H2和NH3的质量分数不再改变 | |
| C. | N2与H2的物质的量之和是NH3的物质的量的2倍 | |
| D. | 单位时间内每增加1mol N2,同时增加3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
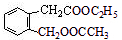 ,D的名称是乙醇.
,D的名称是乙醇.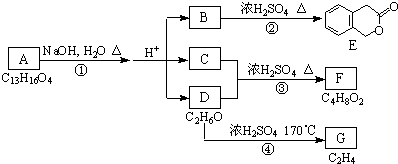
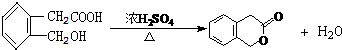 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com