
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。

查阅资料得下表相关数据:
表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因 。
(16分)
(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚 (2分)
(5)Mg(OH)2(s)  Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
【解析】
试题分析:(1)流程图中加入X的目的是将亚铁离子氧化为铁离子,考虑氧化剂的价格,应该选择漂粉;加入Y的目的是调节溶液的pH,使铁离子、锰离子沉淀,碳酸钠溶液显碱性,但碱性不强,所以选择用氢氧化钠;加入Z的目的是使镁离子沉淀,所以选择碳酸钠,且加水煮沸,使生成的碳酸镁沉淀转化为氢氧化镁沉淀,成本较低,因此试剂X、Y、Z最佳选择依次是表2中的a、c、d;
(2)加入NaClO的目的是将亚铁离子氧化为铁离子,离子方程式为2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;步骤⑤是把碳酸镁沉淀转化为氢氧化镁,化学方程式为MgCO3 + H2O△Mg(OH)2+ CO2↑;
(3)根据表1中的数据可知,pH=9.8时铁离子、锰离子完全沉淀,而镁离子开始沉淀,而流程的要求是产品尽量不含杂质,所以步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去;
(4)灼烧时用到的仪器有铁三脚、酒精喷灯、坩埚和泥三角。
(5)NH4Cl溶液中的铵根离子与溶解平衡中Mg(OH)2(s)  Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
考点:考查物质制备,对流程图的分析判断,利用信息的能力,实验仪器的选择,溶解平衡的移动


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:实验题
(11分)在实验室里用乙醇跟浓H2SO4反应制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
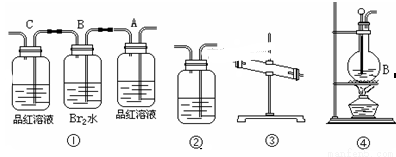
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向):
→ → → →。
(2)实验的装置①中A瓶的现象是________;结论为______________。
B瓶中的现象是________;B瓶溶液作用为________;
是否能将B瓶溶液换成酸性高锰酸钾______ (答是,否)。
(3)装置③中加的固体药品是________装置②中盛的溶液是________。
(4)装置④生成乙烯的反应类型是______ ;若要验证混合气体中有乙烯,应将混合气体先通过盛____________的洗气瓶,再通过盛______ 的试管中。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高二下学期期末考试化学试卷(解析版) 题型:选择题
某有机物的名称是2,2,3,3-四甲基戊烷,下列有关其结构简式的书写正确的是
A.(CH3)3CCH(CH3)2 B.(CH3)3CCH2C(CH3)2
C.(CH3)3CC(CH3)2CH2CH3 D.(CH3)3CC(CH3)3
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.H2S的电子式: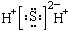 B.钙原子结构示意图:
B.钙原子结构示意图: 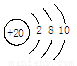
C.Na2O2的电子式: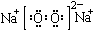 D.铁离子:Fe2+
D.铁离子:Fe2+
查看答案和解析>>
科目:高中化学 来源:2013-2014广东佛山市顺德区高三5月教学质量检测理综化学试卷(解析版) 题型:选择题
某温度下,对可逆反应2X(g) + Y(g)  3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
A.加入少量W,逆反应速率增大,平衡向左移动
B.增大压强,正反应速率增大,逆反应速率减小
C.温度、体积不变,充入He气增大压强,反应速率会加快
D.升高温度,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源:2013-2014广东中山一中、宝安中学等高三七校5月联考化学试卷(解析版) 题型:填空题
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
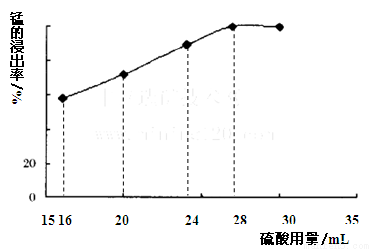
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省汾阳市高一期末统考化学试卷(解析版) 题型:选择题
关于乙醇结构方面的说法中正确的是( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
A.④⑤ B.③⑤ C.①② D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com