
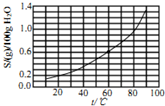
| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
分析 A.常温下溴酸银的溶解度略大于0.2g;
B.由图象可知温度升高,溶解度增大;
C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算;
D.AgI难溶于水,溴酸银微溶于水,以此判断.
解答 解:A.根据图象可知,常温下溴酸银的溶解度大于0.2g,但小于0.3g,微溶于水,故A正确;
B.由图象可知升高温度,溴酸银的溶解度增大,故B正确;
C.60℃时溴酸银的溶解度为0.6g,溴酸银的物质的量为:$\frac{0.6g}{236g/mol}$≈2.5×10-3mol,100.6g溴酸银溶液的体积约为100.6mL,溶液中银离子、溴离子浓度约为2.5×10-2mol/L,所以60℃时溴酸银的Ksp=2.5×10-2×2.5×10-2≈6×10-4,故C错误;
D.AgI难溶于水,溴酸银微溶于水,可知AgI溶解度较小,则往溴酸银浊液中滴加NaI有黄色固体生成,故D正确.
故选C.
点评 本题考查了难溶物的溶解平衡、溶度积的表达式及计算,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度积的概念及计算方法.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲酸能与水以任意比互溶 | |
| B. | 0.1mol/L的甲酸钠溶液的pH约为9 | |
| C. | 0.1mol/L的甲酸溶液的pH约为4.8 | |
| D. | 10mL0.1mol/L的甲酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com