
| A. | 硫酸氢钠属于酸 | |
| B. | 硫酸氢钠属于盐 | |
| C. | 硫酸氢钠属于电解质 | |
| D. | 硫酸氢钠溶液跟锌单质反应生成氢气 |
分析 A、水溶液中电离出的阳离子全部是氢离子的化合物为酸;
B、金属阳离子和酸根阴离子构成的化合物为盐;
C、水溶液或熔融状态导电的化合物为电解质;
D、硫酸氢钠溶液中有氢离子,和锌反应生成氢气.
解答 解:A、水溶液中电离出的阳离子全部是氢离子的化合物为酸,硫酸氢钠电离出的阳离子为Na+、H+,故A错误;
B、金属阳离子和酸根阴离子构成的化合物为盐,硫酸氢钠属于盐,故B正确;
C、水溶液或熔融状态导电的化合物为电解质,硫酸氢钠水溶液中电离出离子,硫酸氢钠属于电解质,故C正确;
D、硫酸氢钠溶液中有氢离子显酸性,氢离子和锌反应生成氢气,故D正确;
故选A.
点评 本题考查了物质分类方法,物质类别的概念分析判断,掌握物质组成和性质是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L溶液中含有0.6NA个SO42-离子 | |
| B. | 2L溶液中H+离子的浓度为1.2mol/L | |
| C. | 1L溶液中含有H+离子0.6mol | |
| D. | 1L溶液中含溶质阴阳离子的总数为0.9NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3v(NH3)=2v(H2O) | |
| B. | 在此条件下,该反应不一定能自发进行 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若降低温度,达到新的化学平衡时,NO的体积分数将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g O2含有4NA个电子 | |
| B. | 1L 1mol•L-1的H2SO4溶液所含氧原子数为4NA | |
| C. | 标准状况下,22.4L O2和CO2的混合气体所含原子数为2.5NA | |
| D. | 标准状况下,22.4L CCl4含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1NH4Cl溶液中:(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1NaHSO3溶液中:c(SO32-)+c(HSO3-)+c(H2SO3)=0.1mol•L-1 | |
| C. | 0.1mol•L-1KAl(SO4)2溶液中:c(SO42-)=c(Al3+)+c(K+) | |
| D. | 0.1mol•L Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中Cl-的物质的量浓度为0.2 mol•L-1 | |
| B. | 该溶液中Ba2+的物质的量浓度为0.1 mol•L-1 | |
| C. | 可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制 | |
| D. | 将20.8 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
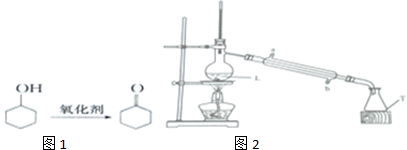
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com