
【题目】下列有关热化学方程式书写及对应表述均正确的是
A. 浓H2SO4与0.1 mol·L-1NaOH反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
B. 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热充分反应,放出19.12 kJ热量。则Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1
C. 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 已知2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1
【答案】B
【解析】
A. 中和热是强酸强碱的稀溶液反应生成1mol水放出的热量,浓H2SO4与0.1 mol·L-1NaOH反应时,浓硫酸稀释也要放热,所以生成1mol水时放出的热量大于57.3 kJ,故A错误;B. 密闭容器中,9.6g硫粉的物质的量为:![]() =0.3mol,11.2g铁粉的物质的量为:
=0.3mol,11.2g铁粉的物质的量为:![]() =0.2mol,二者混合加热发生反应:Fe(s)+S(s)===FeS(s),0.2mol铁完全反应放出热量19.12kJ,则1mol铁完全反应放出热量为19.12kJ×5=95.6kJ,热化学方程式为:Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1,故B正确;C. 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:H2O(l)===H2(g)+
=0.2mol,二者混合加热发生反应:Fe(s)+S(s)===FeS(s),0.2mol铁完全反应放出热量19.12kJ,则1mol铁完全反应放出热量为19.12kJ×5=95.6kJ,热化学方程式为:Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1,故B正确;C. 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:H2O(l)===H2(g)+![]() O2(g) ΔH=+285.5 kJ·mol-1,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物放出的热量,碳燃烧生成的CO不是稳定的氧化物,故D错误;答案选B。
O2(g) ΔH=+285.5 kJ·mol-1,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物放出的热量,碳燃烧生成的CO不是稳定的氧化物,故D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,能达到实验目的的是
A.  验证酸性HCl > H2SiO3
验证酸性HCl > H2SiO3
B. 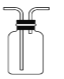 收集 HCl或 CO
收集 HCl或 CO
C. 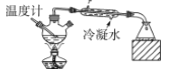 分离沸点不同且互溶的液体混合物
分离沸点不同且互溶的液体混合物
D. ![]() 分离酒精和水
分离酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为气体,对于A+3B![]() 2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
A. v(A)=0.4mol/(Ls)B. v(B)=0.8mol/(Ls)
C. v(C)=0.6mol/(Ls)D. v(D)=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列判断正确的是
A. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 常温下,2.7g金属铝与足量浓度为18mol·L-1的浓硫酸反应时转移的电子数为0.3NA
C. 46g乙醇中含有C—H键的数目为6NA
D. 12.0g 的NaHSO4晶体加热至熔融状态电离出离子的总数是0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖的叙述,错误的是
A.易溶于水,有甜味,属于碳水化合物
B.能发生酯化反应和银镜反应
C.有多种同分异构体,其中之一是果糖
D.能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烯是合成聚氯乙烯(PVC)的单体。乙烯氧氯化法是生产氯乙烯的主要方法,分三步进行(如图所示):

(1)下列关于乙烯、氯乙烯和聚氯乙烯的说法中,正确的是________(填字母)。
A.都能在氧气中燃烧 B.都能发生加成反应使溴水褪色
C.都能使高锰酸钾酸性溶液褪色 D.氯乙烯分子中所有原子处于同一平面
(2)从环境保护的角度分析,氧氯化法的优点是_______________________________。
(3)某学生设计了下列反应:
![]()
请写出③的化学方程式________________________________________________。
(4)已知二氯乙烷与NaOH溶液共热可生成乙二醇(HO—CH2CH2—OH),请写出乙二醇与乙酸发生完全酯化反应的化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
①2v(NH3)=v(CO2)②密闭容器中总压强不变③密闭容器中混合气体的密度不变④密闭容器中氨气的体积分数不变
A. ①② B. ②③ C. ②④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径:X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com