
【题目】某兴趣小组用下图装置探究氨的催化氧化。
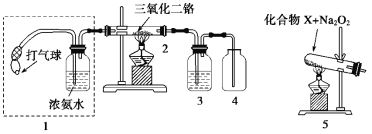
(1)氨催化氧化的化学方程式为____。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是__(填“吸热”或“放热”)反应。
(3)为实现氨催化氧化,也可用装置5替换装置1,若化合物X为NH4HCO3,NH4HCO3发生分解反应,该反应的化学方程式为___,部分产物和Na2O2反应得到O2,使NH3和O2混合催化氧化,装置4中可以观察到有红棕色气体生成,红棕色气体生成的化学方程式为___。
(4)为保证在装置4中观察到红棕色气体,装置3中应装入___。若取消装置3,在装置4中会观察到产生大量白烟,该白烟的化学式是___。
【答案】4NH3+5O2![]() 4NO+6H2O 放热 NH4HCO3
4NO+6H2O 放热 NH4HCO3![]() NH3↑+CO2↑+H2O 2NO+O2=2NO2 浓H2SO4 NH4NO3
NH3↑+CO2↑+H2O 2NO+O2=2NO2 浓H2SO4 NH4NO3
【解析】
(1)氨催化氧化,生成一氧化氮和水。
(2)停止加热后仍能保持红热,该反应能继续释放维持反应进行的热量。
(3)若化合物X为NH4HCO3,NH4HCO3发生分解反应,则生成氨气、二氧化碳和水,二氧化碳和水能与Na2O2反应得到O2,使NH3和O2混合催化氧化,装置4中可以观察到有红棕色气体生成,红棕色气体由一氧化氮与氧气反应生成。
(4)为保证在装置4中观察到红棕色气体,装置3中应装入去除氨气的物质。若取消装置3,在装置4中会观察到产生大量白烟,该白烟应为氨气与硝酸反应的产物。
(1)氨催化氧化,生成一氧化氮和水,方程式为4NH3+5O2![]() 4NO+6H2O。答案为:4NH3+5O2
4NO+6H2O。答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)停止加热后仍能保持红热,说明该反应放热。答案为:放热;
(3)若化合物X为NH4HCO3,NH4HCO3发生分解反应,NH4HCO3![]() NH3↑+CO2↑+H2O,后续反应为:2Na2O2+2H2O==4NaOH+O2↑,2Na2O2+2CO2==2Na2CO3+O2,4NH3+5O2
NH3↑+CO2↑+H2O,后续反应为:2Na2O2+2H2O==4NaOH+O2↑,2Na2O2+2CO2==2Na2CO3+O2,4NH3+5O2![]() 4NO+6H2O,2NO+O2==2NO2。答案为:NH4HCO3
4NO+6H2O,2NO+O2==2NO2。答案为:NH4HCO3![]() NH3↑+CO2↑+H2O;2NO+O2=2NO2;
NH3↑+CO2↑+H2O;2NO+O2=2NO2;
(4)为保证在装置4中观察到红棕色气体,装置3中应装入去除氨气的物质,以应使用浓H2SO4。若取消装置3,在装置4中会观察到产生大量白烟,则发生反应为3NO2+H2O==2HNO3+NO,NH3+HNO3=NH4NO3(白烟)。答案为:浓H2SO4;NH4NO3。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量/mol | 0.2 | 0.2 | 0 |
平衡物质的量/mol | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为![]() ,其平衡常数为8 000
,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,则平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度,Z的浓度增大,则温度升高时![]() 正增大,
正增大,![]() 逆减小
逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,11.2L盐酸的原子总数为NA
B.常温常压下,14gN2含有的分子数为0.5NA
C.标准状况下,6.72L氖气中含有的分子数为0.3NA
D.常温常压下,9gH2O中含有的原子总数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,发生可逆反应:M(g)+N(g)![]() 2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是________,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:

A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
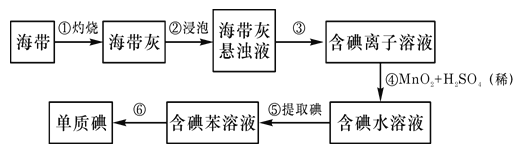
【题目】海带中含有丰富的碘。为从海带中提取碘,某研究性学习小组设计并进行以下实验:
请填写下列空白:
(1)步骤③中过滤操作时,除需要铁架台、烧杯等,还需用到的玻璃仪器是___。
(2)步骤④中反应的离子方程式是___。
(3)步骤⑤和⑥的实验操作名称分别是___和____。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与碘单质不反应,___。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比为___。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。该电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
A.放电时,正极反应为Cd-2e-+2OH-=Cd(OH)2
B.充电时,阳极区附近溶液的pH不断变小
C.放电时,每转移0.2mol电子,有0.1mol负极材料被还原
D.充电时,阴极反应为2NiOOH-2e-+2OH-=2Ni(OH)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图装置进行铜与浓硫酸反应时,发现试管中有黑色物质产生。同学猜测,黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学继续进行实验探究,获得数据如表。下列说法不正确的是
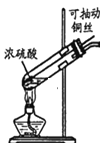
硫酸浓度/ mol·L﹣1 | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
A.硫酸浓度越大,黑色物质越易出现、越难消失
B.黑色物质消失过程中有SO2、H2S生成
C.硫酸浓度为16 mol·L﹣1时,先升温至250℃以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质
D.取黑色物质洗涤、干燥后,加稀硫酸充分混合,固体质量不变,说明黑色物质中不含CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
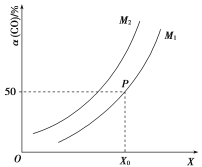
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com