
) 向27.2Cu和Cu2O的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。则:
(1)Cu与Cu2O 的物质的量之比为 。
(2)HNO3的物质的量浓度为 。
【知识点】硝酸性质 金属及其化合物性质D4 C3
【答案解析】 (1)2:1 (2)2.4mol/L
解析:(1)所得沉淀为氢氧化铜质量39.2g,氢氧化铜的物质的量是39.2g/(98g/mol)=0.4mol,假设Cu和Cu2O物质的量分别为x、y,则x+2y=0.4;64x+144y=27.2,解得x=0.2,y=0.1;所以Cu与Cu2O 的物质的量之比为2:1
(2)混合物中加入某浓度的稀HNO3500mL,固体完全溶解后在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,溶液是硝酸钠溶液,溶液中的硝酸根物质的量等于NaOH的物质的量:1mol/L×1L=1mol;设还原的硝酸zmol,据电子守恒3z=0.2×2+0.1×2×1,解得z=0.2,原来加入的硝酸的物质的量是1mol+0.2mol=1.2mol;HNO3的物质的量浓度为1.2mol/0.5L=2.4mol/L
【思路点拨】本题考查了硝酸性质的运用,关键是利用质量守恒、电子守恒、等解决问题。


科目:高中化学 来源: 题型:
下列实验装置用途正确的是
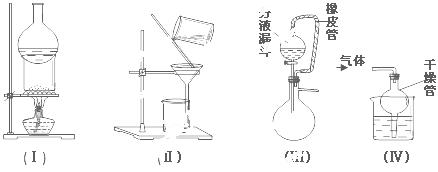
A.装置(Ⅰ)用于I2与NH4Cl混合物的分离。
B.装置(Ⅱ)用于去除Fe(OH)3胶体中含有的可溶性物质。
C.装置(Ⅲ)橡皮管起到平衡气压、使液体顺利流下的作用。
D.装置(Ⅳ)用于HCl或NH3吸收,以防倒吸。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是含单官能团的化合物,A水解得B和C,B氧化可以得到C或D,D氧化也可得到C。若M(X)表示X的摩尔质量,则下列关系式正确的是( )
A.M(A)=M(B)+M(C)
B.2M(D)=M(B)+M(C)
C.2M(B)>M(D)+M(C)
D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极;②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D—→导线—→C;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀硫酸溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同?
________________________________________________________________________。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。
铝为( ):
________________________________________________________________________。
石墨为( ):
________________________________________________________________________。
电池总反应:
________________________________________________________________________。
(3)实验4中的铝作正极还是负极?________,为什么?
________________________________________________________________________
________________________________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:
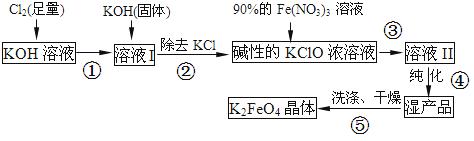
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3+ + 2I-= Fe2+ + I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42-+ Ba2+ + 3OH-= Fe(OH)3↓+ BaSO4↓
D. 1L0.1mol/L该溶液和足量的Zn充分反应,生成 11.2gFe
查看答案和解析>>
科目:高中化学 来源: 题型:
最近医学界通过用放射性14C来标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是 ( )
A.与C60中普通碳原子的化学性质不同
B.与14N中含的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com