
| 选项 | X | Y |
| A | NH3 | CO2 |
| B | Cl2 | CO2 |
| C | SO2 | NO2 |
| D | Cl2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先通入氨气,溶液呈碱性,再通入二氧化碳气体,可生成碳酸钡沉淀;
B.通入氯气,溶液呈酸性,通入二氧化碳不反应;
C.NO2、SO2发生氧化还原反应生成硫酸和硝酸;
D.Cl2、SO2发生氧化还原反应可生成硫酸,可生成硫酸钡沉淀.
解答 解:A.BaCl2溶液中先通入氨气,溶液呈碱性,再通入二氧化碳气体,碱性条件下可生成碳酸钡沉淀,故A不选;
B.通入氯气,溶液呈酸性,通入二氧化碳不反应,且二氧化碳难溶于酸性溶液,不能生成沉淀,故B选;
C.NO2、SO2发生氧化还原反应生成硫酸和硝酸,然后与氯化钡反应生成硫酸钡沉淀,故C不选;
D.发生Cl2+SO2+2H2O═H2SO4+2HCl,H2SO4+BaCl2═BaSO4↓+2HCl,可生成沉淀,故D不选.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重元素化合物性质的考查,涉及氧化还原反应及复分解反应等,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
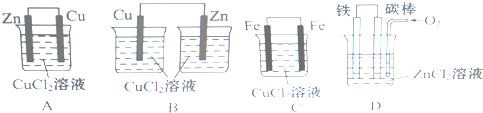
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

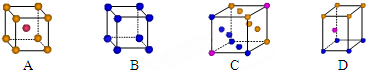
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
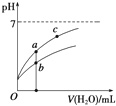 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$相等(HP代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.| A. | K+从右到左通过离子交换膜 | |
| B. | 电极M的反应式:I3-+2e-=3I- | |
| C. | 电极X的反应式:4OH--4e-═O2↑+2H2O | |
| D. | 当电极Y有0.2mole-转移时,产生0.1molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2 | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
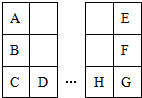 A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )| A. | 原子半径:H>F>E | |
| B. | 金属性:A>B>D | |
| C. | C与G的原子核外电子数相差3 | |
| D. | B的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | B. | 升高温度可减小反应速率 | ||
| C. | 达到平衡时,v(正)=v(逆)=0 | D. | 达到平衡时,NO2转化率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com