
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
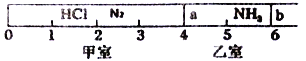
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________’’处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1,的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)
Ⅲ.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:_________________________________。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜的H+为________mol。
【答案】 73∶168 4 25.25 ![]() C1/2 大于 NO2-e-+H2O=NO3-+2H+ 0.1
C1/2 大于 NO2-e-+H2O=NO3-+2H+ 0.1
【解析】试题分析:Ⅰ.依据相同条件下,气体体积比等于气体物质的量比分析;Ⅱ.(1)根据c=![]() 计算;
计算;
(2)根据稀释过程中溶质的质量不变列式;
(3)氨水的浓度越高,其密度就越小,c2molL-1和0.2c2molL-1的氨水等质量混合,c2molL-1的氨水体积大;
Ⅲ.根据图示,左室有氢气生成,所以左室是阴极发生还原反应,右室是阳极发生氧化反应。
解析:Ⅰ.(1)看图可知甲、乙两室气体的体积比为2:1,故其物质的量之比为2:1,所以甲室中气体为0.8mol。 (2)NH3气体的质量为0.4mol×17g/mol=6.8g,则甲室中气体的质量为6.8g+17.3g =24.1g。 设 HCl 的物质的量是xmol,则36.5x+28(0.8-x)= 24.1g; x=0.2mol;所以氯化氢的质量是7.3g,氮气的质量是16.8g,HCl、N2的质量之比为73∶168;(2)将隔板a去掉,氨气和氯化氢反应生成氯化铵固体,反应后剩余0.6molN2和0.2molNH3,所以隔板b将稳定位于刻度“4’处;此时体系的平均相对分子质量为![]() 25.25;
25.25;
Ⅱ.(1)根据c=![]() ,表中硫酸的质量分数为
,表中硫酸的质量分数为![]() 。
。
(2)根据稀释过程中溶质的质量不变,物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为![]() = C1/2molL-1。
= C1/2molL-1。
(3)根据题意,将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等体积混合,所得溶液的物质的量浓度![]() ,氨水的浓度越高,其密度就越小,c2molL-1和0.2c2molL-1的氨水等质量混合,c2molL-1的氨水体积大,所以混合后,浓度大于0.6c2molL-1;
,氨水的浓度越高,其密度就越小,c2molL-1和0.2c2molL-1的氨水等质量混合,c2molL-1的氨水体积大,所以混合后,浓度大于0.6c2molL-1;
Ⅲ.根据图示,左室有氢气生成,所以左室是阴极,右室是阳极,①电解时NO2发生氧化反应反应,电极反应式:NO2-e-+H2O=NO3-+2H+。
②根据阳极反应式,若有标准状况下2.24LNO2被吸收,转移电子0.1mol,根据电荷守恒,通过阳离子交换膜的H+为0.1mol;


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为______mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______;
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为 0.400mol·L-1的稀盐酸。
①容量瓶上需标有以下五项中的________。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序________(用字母表示,每个字母只能用一次);
A.用少量蒸馏水洗涤________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。
B.用量筒准确量取浓盐酸 ________mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀。
C.将已冷却的盐酸沿玻璃杯注入________中。
D.盖好瓶塞,颠倒摇匀,装瓶,贴签。
E.改用__________加水,至_____________________________。
F.继续往容量瓶内小心加水,直到液面接近刻度________处。
③在配制过程中,下列实验操作对所配制的稀盐酸物质的量浓度有何影响? (在横线上天“偏大”、“偏小”、“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面__________;
b.洗涤量取浓盐酸后的量筒,并将洗涤液转移到容量瓶中__________;
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水___________;
d.定容时仰视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。A为含硫氮正盐其中硫元素化合价为+4,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:

(1)写出下列物质化学式:D:__________;F:__________。
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液反应__________;
②D和新制氯水:__________。
(3)通过本题的解答,在检验SO42-时,应使用__________。
A.盐酸酸化的BaCl2溶液 B.硝酸酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种化合物,各取30 g相混合,完全反应后,得到8.0 g B、39.0 g C,还有D生成,已知D的相对分子质量为86。现将22.0 g A和11.0 g B反应,能生成D的物质的量为( )
A. 1.00 mol B. 0.500 mol C. 0.25 mol D. 0.275 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,五种含有同种金属元素的单质或其化合物,能按如图箭头方向实现一步转化(不含电解),该金属元素可能是( )

①Fe ②Cu ③Al ④Na
A. ①② B. ②④
C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2-甲基丁烷也称为异丁烷
B. 由乙烯生成乙醇属于加成反应
C. ![]() 有3种同分异构体
有3种同分异构体
D. 油脂和蛋白质都属于高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com