
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
分析 A.根据电荷守恒分析;
B.NaHSO4溶液中电离出钠离子、氢离子和硫酸根离子,酸碱中和反应的实质是氢离子和氢氧根离子之间的反应,根据二者量的关系结合公式pH=-lg[H+]来计算;
C.NaHSO4与Ba(OH)2恰好完全反应生成BaSO4沉淀、NaOH和水,根据电荷守恒分析;
D.混合后溶液中溶质主要是NaOH,NaOH会抑制水的电离.
解答 解:A.NaHSO4溶液中完全电离出钠离子、氢离子和硫酸根离子,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(SO42-),故A错误;
B.NaHSO4溶液中电离出钠离子、氢离子和硫酸根离子,NaHSO4溶液中离子的总浓度为0.6mol/L,所以氢离子的浓度为0.2mol/L,离子浓度为0.6mol/L的Ba(OH)2溶液中氢氧根离子的浓度为0.4mol/L,所以等体积混合反应后,氢氧根离子回剩余,氢氧根的浓度为$\frac{0.4V-0.2V}{2V}$=0.1mol/L,氢离子浓度为1×10-13mol/L,所以溶液的pH=13,故B正确;
C.NaHSO4与Ba(OH)2恰好完全反应生成BaSO4沉淀、NaOH和水,溶液中电荷守恒为:2c(Ba2+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(Ba2+)=c(SO42-),所以c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-),故C正确;
D.混合后溶液中溶质主要是NaOH,NaOH在水中电离出较多的氢氧根离子会抑制水的电离,所以混合溶液水电离程度比纯水的小,故D正确.
故选A.
点评 本题考查了混合溶液中pH的计算、溶液中守恒关系的应用、影响水的电离的因素等,题目难度中等,注意把握酸碱混合溶液的pH的计算方法,侧重于考查学生的分析能力和计算能力.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑥⑦ | C. | ⑤⑥⑦ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
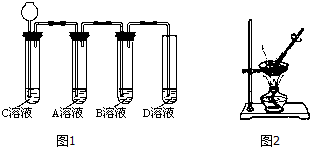
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
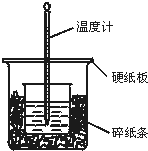 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
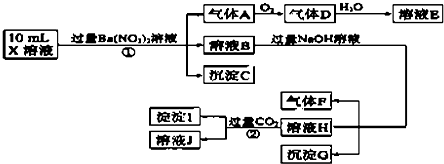
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com