
化工原料红矾钠(重铬酸钠:Na2Cr2O7?2H2O)主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下: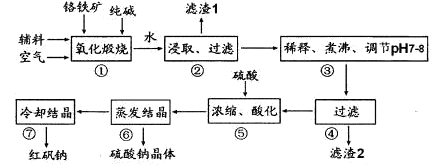
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: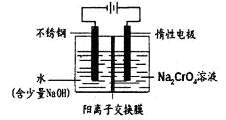
阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
(17分)
(1)增大反应物的接触面积(1分),加快反应速率(1分)
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑ (2分) SiO2+Na2CO3
2NaAlO2+CO2↑ (2分) SiO2+Na2CO3 Na2SiO3+CO2↑ (2分)
Na2SiO3+CO2↑ (2分)
(3)水解吸热,煮沸促进AlO2-+2H2O Al(OH)3+OH-(1分),SiO32-+H2O
Al(OH)3+OH-(1分),SiO32-+H2O HSiO3-+OH-(1分)水解平衡向右移动,生成氢氧化铝、硅酸沉淀(1分)(合理即给分)
HSiO3-+OH-(1分)水解平衡向右移动,生成氢氧化铝、硅酸沉淀(1分)(合理即给分)
H+将水解生成的氢氧化铝沉淀溶解(1分),杂质Al3+难与Na2CrO4分离(1分)(合理即给分)
(4)2CrO42-+ 2H+ Cr2O72-+ H2O (2分,写=不扣分)
Cr2O72-+ H2O (2分,写=不扣分)
(5)阴极:4H2O+4e-=4OH-+2H2↑ 或 2H2O+2e-=2OH-+H2↑
或4 H++4e-=2H2↑ 或2 H++2e-=H2↑(2分)
阳极:2H2O-4e-= O2↑+4H+ 或 4OH-—4e-=O2↑+2H2O (2分)
解析试题分析:(1)①中固体反应物与空气中的氧气发生反应时,不断搅拌能增大反应物的接触面积,加快反应速率;(2)氧化铝是两性氧化物,二氧化硅是酸性氧化物,都能与NaOH反应生成盐和水,则Al2O3+Na2CO3 2NaAlO2+CO2↑、SiO2+Na2CO3
2NaAlO2+CO2↑、SiO2+Na2CO3 Na2SiO3+CO2↑;(3)由于①中除杂试剂一定过量,则氧化煅烧、冷却、溶解后所得滤渣的主要成分是氧化铁等难溶物,滤液中主要成分是铬酸钠、偏铝酸钠、硅酸钠、碳酸钠,由于酸性:碳酸>硅酸>氢氧化铝,则水解程度:偏铝酸钠>硅酸钠>碳酸钠,因为它们的水解反应是吸热反应,则③中煮沸的作用是促进AlO2-+2H2O
Na2SiO3+CO2↑;(3)由于①中除杂试剂一定过量,则氧化煅烧、冷却、溶解后所得滤渣的主要成分是氧化铁等难溶物,滤液中主要成分是铬酸钠、偏铝酸钠、硅酸钠、碳酸钠,由于酸性:碳酸>硅酸>氢氧化铝,则水解程度:偏铝酸钠>硅酸钠>碳酸钠,因为它们的水解反应是吸热反应,则③中煮沸的作用是促进AlO2-+2H2O Al(OH)3+OH-、SiO32-+H2O
Al(OH)3+OH-、SiO32-+H2O HSiO3-+OH-或SiO32-+2H2O
HSiO3-+OH-或SiO32-+2H2O H2SiO3-+2OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀,即成为滤渣2的主要成分;若调节pH过低,酸性过强,由于氢氧化铝是两性氢氧化物,则H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离;(4)④的滤液的主要成分是铬酸钠、碳酸钠,则⑤酸化的原理是铬酸钠、碳酸钠分别与硫酸反应,生成重铬酸钠、硫酸钠等,则2CrO42-+ 2H+
H2SiO3-+2OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀,即成为滤渣2的主要成分;若调节pH过低,酸性过强,由于氢氧化铝是两性氢氧化物,则H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离;(4)④的滤液的主要成分是铬酸钠、碳酸钠,则⑤酸化的原理是铬酸钠、碳酸钠分别与硫酸反应,生成重铬酸钠、硫酸钠等,则2CrO42-+ 2H+ Cr2O72-+ H2O,加入硫酸能增大氢离子浓度,使该反应的平衡右移,将铬酸钠转化为重铬酸钠;(5)读图,与负极相连的不锈钢是阴极,阳离子移向阴极,氢离子比钠离子容易得到电子,则阴极反应式为2 H++2e-=H2↑或4 H++4e-=2H2↑或2H2O+2e-=2OH-+H2↑或4H2O+4e-=4OH-+2H2↑;与正极相连的惰性电极为阳极,阴离子移向阳极,氢氧根离子比铬酸根离子容易失去电子,则阳极反应式为4OH-—4e-=O2↑+2H2O或2H2O-4e-= O2↑+4H+,则阳极附近溶液的pH减小,使平2CrO42-+ 2H+
Cr2O72-+ H2O,加入硫酸能增大氢离子浓度,使该反应的平衡右移,将铬酸钠转化为重铬酸钠;(5)读图,与负极相连的不锈钢是阴极,阳离子移向阴极,氢离子比钠离子容易得到电子,则阴极反应式为2 H++2e-=H2↑或4 H++4e-=2H2↑或2H2O+2e-=2OH-+H2↑或4H2O+4e-=4OH-+2H2↑;与正极相连的惰性电极为阳极,阴离子移向阳极,氢氧根离子比铬酸根离子容易失去电子,则阳极反应式为4OH-—4e-=O2↑+2H2O或2H2O-4e-= O2↑+4H+,则阳极附近溶液的pH减小,使平2CrO42-+ 2H+ Cr2O72-+ H2O衡右移,将铬酸钠转化为重铬酸钠。
Cr2O72-+ H2O衡右移,将铬酸钠转化为重铬酸钠。
考点:考查有关物质制备的化学工艺流程,涉及解释搅拌的作用、化学方程式、解释原因、离子方程式、阴极反应式、阳极反应式等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(1)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。乙酰水杨酸的结构简式为 。
。
现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1 mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
①写出乙酰水杨酸与NaOH溶液反应的化学方程式 ;
②计算出产品纯度为 (只需列出计算表达式,不必化简。乙酰水杨酸相对分子质量为180)。
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点。(已知二甲醚直接燃料电池能量密度E =8.39 kW·h·kg-1)。
①若电解质为酸性,甲醇直接燃料电池的负极反应为 ;
②该电池的理论输出电压为1.20 V,能量密度E = (列式计算。能量密度 = 电池输出电能/燃料质量,lkW·h = 3.6×106J,一个电子的电量=1.6×10-19C)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
(1)打开K2,闭合K1,B为_______极,A的电极反应为_____,最终可观察到的现象是 。
(2)打开K1,闭合K2,E为_______极,检验F极产生气体的方法是 。该装置中发生反应的化学方程式为_________。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时, 极周围能变红(填A、B、E、或F)。
(4)若电源选用燃料电池,结构如下图,以熔融碳酸盐为电解质(非水溶济,能够传导CO32-),电池工作时电解质组成保持稳定,通入甲烷的电极为________极,请写出正极反应的方程式 ,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为 mol(假设燃料电池能量转化率为75%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为细菌冶铜和火法冶铜的主要流程。
(1) 硫酸铜溶液一般呈________(填“酸”、“碱”或“中”)性,原因是________ (用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:______________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为________________(写出一点即可)。
(3) 用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?________(填“正确”或“不正确"),原因是__________
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:
CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是________(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量________固体于试管中,加入________使其溶解,再加入________溶液,观察现象。
④已知电解前,U形管中加入了________100mL0.5 mol . L-1 CuCl2溶液,电解结朿时电路中一共转移了 0.03 mol电子,且阴极生成0. 64 g铜,则形成的低价阳离子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: 
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
有人设计以Pt和Zn为电极材料,埋入人体作某种心脏起搏器的能源。它依靠人体内体液中含有一定物质的量浓度的溶解氧、H+和Zn2+进行工作。试写出两极反应的方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【选修2化学与技术】(15分)
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: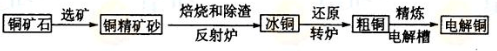
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、
,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。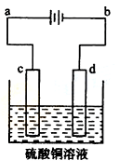
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com