
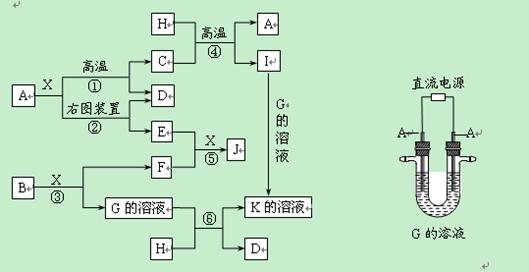
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.一个O4分子由两个O2分子构成 | B.O4是一种单质 |
| C.等质量的O4和O2含有相同数目的原子 | D.O4是一种化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
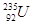 是重要的工业原料,铀浓缩一直为国际社会关注。下列有关
是重要的工业原料,铀浓缩一直为国际社会关注。下列有关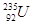 的说法正确的是
的说法正确的是A.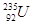 原子核中含有92个中子 原子核中含有92个中子 | B.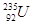 原子核外有143个电子 原子核外有143个电子 |
C.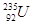 与 与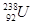 互为同位素 互为同位素 | D.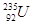 与 与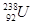 是两种不同的元素 是两种不同的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
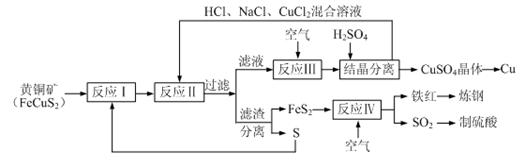
 3++
3++  Fe3++ H2O(未配平)
Fe3++ H2O(未配平)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
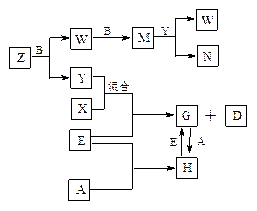
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
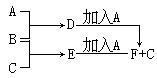
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com