
把500ml含有BaCl2和KCl的混合溶液分成5等分,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀,则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol·L-1 B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1 D.10(b-2a) mol·L-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
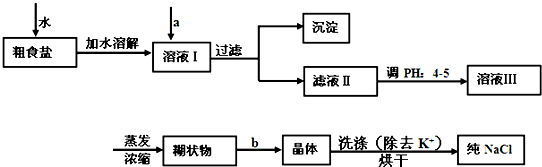
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
验数据回答下列问题:
(1)该学生用0.020mol•L-1标准的NaOH溶液中和过量的盐酸的实验操作如下:
A.用酸式滴定管取待测液25mL,注入锥形瓶中并加入指示剂
B.用待测液润洗酸式滴定管
C.滴定管用蒸馏水洗净
D.取下碱式滴定管,用标准的NaOH溶液润洗后,将标准碱液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”
E.检查滴定管是否漏水,并分别固定在滴定管夹的两边
F.另取锥形瓶,再重复操作一次
G.将锥形瓶放在滴定管的下面,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入1滴碱液后,溶液的颜色突变,并在半分钟内不再变色,记下滴定管液面所在的刻度。
①滴定操作的正确顺序是(填序号).________。
②该滴定操作中应选用的指示剂是________。
③在D步操作中,调节液面至刻度“0”的目的是________。
(2)误差分析,填“偏高”“偏低”“无影响”:
①碱式滴定管用蒸馏水洗净后,未用标准碱液润洗,导致测定盐酸的量________。
②记录滴定结果时,俯视刻度线读数,导致测定盐酸的量________。
(3)结论及数据处理:
①样品中含有哪些物质?
②样品中各物质的质量分数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:058
某学生对久置于空气中已经变质的CaO取样分析,实验如下:取10.00g样品高温灼烧,将生成的气体全部通入足量的Ba(OH)2溶液中,得到3.94g沉淀,另取1.00g样品,加入40mL1.0mol•L-1的稀盐酸,充分反应后,稀释到500mL,从中取出25mL,以0.020mol•L-1的NaOH溶液中和过量的盐酸,用去23mLNaOH溶液,根据以上实
验数据回答下列问题:
(1)该学生用0.020mol•L-1标准的NaOH溶液中和过量的盐酸的实验操作如下:
A.用酸式滴定管取待测液25mL,注入锥形瓶中并加入指示剂
B.用待测液润洗酸式滴定管
C.滴定管用蒸馏水洗净
D.取下碱式滴定管,用标准的NaOH溶液润洗后,将标准碱液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”
E.检查滴定管是否漏水,并分别固定在滴定管夹的两边
F.另取锥形瓶,再重复操作一次
G.将锥形瓶放在滴定管的下面,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入1滴碱液后,溶液的颜色突变,并在半分钟内不再变色,记下滴定管液面所在的刻度。
①滴定操作的正确顺序是(填序号).________。
②该滴定操作中应选用的指示剂是________。
③在D步操作中,调节液面至刻度“0”的目的是________。
(2)误差分析,填“偏高”“偏低”“无影响”:
①碱式滴定管用蒸馏水洗净后,未用标准碱液润洗,导致测定盐酸的量________。
②记录滴定结果时,俯视刻度线读数,导致测定盐酸的量________。
(3)结论及数据处理:
①样品中含有哪些物质?
②样品中各物质的质量分数为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com