
����Ŀ����֪�� C��s��+O2��g���TCO2��g����H1
CO2��g��+C��s���T2CO��g����H2
2CO��g��+O2��g���T2CO2��g����H3
4Fe��s��+3O2��g���T2Fe2O3��s����H4
3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H5
���й���������Ӧ�ʱ���ж���ȷ���ǣ� ��
A.��H1��0����H3��0
B.��H2��0����H4��0
C.��H1=��H2+��H3
D.��H3=��H4+��H5
���𰸡�C
���������⣺A�����е�ȼ�շ�Ӧ���ڷ��ȷ�Ӧ����ˡ�H1��0����H3��0����A���� B��̼��ԭ������̼�ķ�Ӧ�������ȷ�Ӧ����H2��0�����������ķ�Ӧ���ڷ��ȷ�Ӧ����H4��0����B����
C����֪����C��s��+O2��g���TCO2��g����H1��CO2��g��+C��s���T2CO��g����H2��2CO��g��+O2��g���T2CO2��g����H3 �� �ɸ�˹���ɿ�֪��=��+�ۣ���ˡ�H1=��H2+��H3 �� ��C��ȷ��
D����֪��2CO��g��+O2��g���T2CO2��g����H3��4Fe��s��+3O2��g���T2Fe2O3��s����H4��3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H5 �� �ɸ�˹���ɿ�֪��= ![]() ����
���� ![]() ��+�ݣ�����ˡ�H3=
��+�ݣ�����ˡ�H3= ![]() ��H4+
��H4+ ![]() ��H5 �� ��D����
��H5 �� ��D����
��ѡC��
A�����е�ȼ�շ�Ӧ���ڷ��ȷ�Ӧ��
B����̼��Ϊ��ԭ���ķ�Ӧͨ��Ϊ���ȷ�Ӧ�������������ڷ��ȷ�Ӧ��
C�����ݸ�˹�������üӺϷ����з�����
D�����ݸ�˹�������üӺϷ����з�����


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£������кϳɲ���ش����⣺
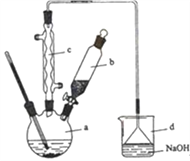
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������_____���塣�����μ���Һ����ꡣװ��d��������________����ȡ�屽�Ļ�ѧ����ʽ____________________________��
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӡ�NaOH��Һϴ�ӵ������ǣ�______��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����_____��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ_______________��Ҫ��һ���ᴿ�����в����б������_________(������ȷѡ��ǰ����ĸ)��
A.�ؽᾧ B.���� C.���� D.��ȡ
��4��ȡ��Ӧ���ձ��е���Һ2 mL����������ϡ�����ữ���ٵ���AgNO3��Һ����dz��ɫ��������___(�ܻ���)֤������Һ�巴����ȡ����Ӧ��Ϊʲô? _______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�м�������ᾧ�壬�ָ������£������Һ��pHΪ2�����жԸ���Һ�������в���ȷ���ǣ� ��
A.������Һ��Ũ��Ϊ0.01mol/L
B.��ˮ���������H+��Ũ����1.0��10��12 mol/L
C.�����ᾧ��ļ���������ˮ�ĵ���
D.���¶��¼�������pHΪ12��NaOH��Һ��ʹ����Һǡ�ó�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA���̣�+nB������pC��������H��0��һ���¶���B�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ� �� 
A.m+n��P
B.n��p
C.x���ʾ�÷�Ӧ������Ӧ����С���淴Ӧ����
D.x���y��ʱ�ķ�Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������(Na2FeO4)��װ����ͼ��ʾ������˵����ȷ����( )
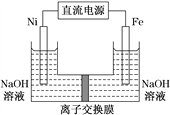
A. �����������缫��ӦΪFe��2e����2OH��===Fe(OH)2
B. ���һ��ʱ������缫������Һ��c(OH-)��С
C. �����ӽ���ĤΪ�����ӽ���Ĥ����������������Һ�к���FeO![]()
D. ÿ�Ƶ�1 mol Na2FeO4�������Ͽ��Բ���67.2 L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�������
��1�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
����������ȣ�������Ϊȼ�ϵ��ŵ���_____________________(���ٴ������)��
������̫����ֱ�ӷֽ�ˮ���⣬�����������������;����������ת����ʽΪ____________��
��2���л���M����̫������տ�ת����N��ת���������£�
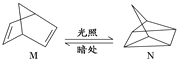 ��H����88.6 kJ��mol��1����M��N��ȣ����ȶ�����____________��
��H����88.6 kJ��mol��1����M��N��ȣ����ȶ�����____________��
��3������͵�������ı������������ʡ���ʯī�����ۺͶ�������һ��������ϸ��������գ�����������²��ϣ�4Al(s)��3TiO2(s)��3C(s)===2Al2O3(s)��3TiC(s)��H����1 176 kJ��mol��1����Ӧ�����У�ÿת��1 mol���ӷų�������Ϊ______________��
��4����һ���¶��£�4 L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ��
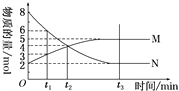
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
����t2��2 min�����㷴Ӧ��ʼ��t2ʱ����M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ______________��
��t2ʱ�̣���Ӧ���ת����Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ��Ļ������У��ڳ��¡���ѹ����Һ̬��ʽ���ڵ��ǣ� ��
A.����
B.��Ȳ
C.��ϩ
D.�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(�Է�ĩ״����)�Ͱ�������������ͬ�������塣
��֪����Sn(s����)��2HCl(aq)===SnCl2(aq)��H2(g)����H1
��Sn(s����)��2HCl(aq)===SnCl2(aq)��H2(g)����H2
��Sn(s����) ![]() Sn(s����)����H3����2.1kJ��mol��1
Sn(s����)����H3����2.1kJ��mol��1
����˵����ȷ����(����)
A. ��H1>��H2
B. ���ڳ������Ի���״̬����
C. ����ת��Ϊ�����ķ�Ӧ�Ƿ��ȷ�Ӧ
D. ���������ڴ��ڵ���13.2���Ļ����У������лٻ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com