
��úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C(s)��H2O(g)  CO(g)��H2(g)
��H= +131.3 kJ•mol-1��
CO(g)��H2(g)
��H= +131.3 kJ•mol-1��
�ٸ÷�Ӧ�ڳ����� �Է����У���ܡ��롰���ܡ�����
��һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����ͬ����
a�������е�ѹǿ���� b��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
c��c(CO)=c(H2) d���ܱ��������ݻ����ٸı�
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ
CO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
|
ʵ����] |
�¶�/��[��] |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min[��Դ:Zxxk.Com] |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
��ʵ��1����v (CO2) ��ʾ�ķ�Ӧ����Ϊ ��ȡС����λ����ͬ����
�ڸ÷�ӦΪ ��������š����ȷ�Ӧ��ʵ��2������ƽ�ⳣ��K= ��
����ʵ��3��ƽ��ʱ��ʵ��2ƽ��״̬�и����ʵ����������ֱ���ȣ���t<3min����a��bӦ����Ĺ�ϵ�� ���ú�a��b����ѧʽ��ʾ����
 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| ���� |
| ʵ�� ��� |
�¶ȡ� | ��ʼ��/mol | ƽ��/mol | ��ƽ���� ��ʱ��/min | ||||
| H2O | CO | H2 | CO2 | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 0 | a | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0 | b | 0.4 | 1.6 | 3 |
| ���� |
| ��� | �¶� | ���� | �� |
| 1 | |||
| 2 | |||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CO��g��+H2��g����H=+131.3kJ?mol-1��
CO��g��+H2��g����H=+131.3kJ?mol-1��| ��ѧ�� | C-O | C-H | H-H | C��O | O-H |
| ���� kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
 2NH3��g����H=-92.4kJ/mol
2NH3��g����H=-92.4kJ/mol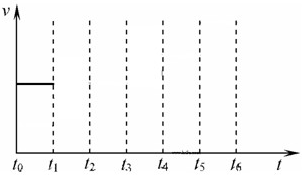 ��һ�������������У����ϳɰ���Ӧ�ﵽƽ�����t1ʱ�����¶ȣ�t2���´ﵽƽ�⣬t3ʱ���뵪����t4ʱ���´ﵽƽ�⣬t5ʱ��ȥһ���ֲ��t6ʱ�ִﵽƽ�⣬��������ķ�Ӧ������ʱ���ϵͼ�л���t1��t5�淴Ӧ���ʡ�t5��t6����Ӧ���ʵı仯�����
��һ�������������У����ϳɰ���Ӧ�ﵽƽ�����t1ʱ�����¶ȣ�t2���´ﵽƽ�⣬t3ʱ���뵪����t4ʱ���´ﵽƽ�⣬t5ʱ��ȥһ���ֲ��t6ʱ�ִﵽƽ�⣬��������ķ�Ӧ������ʱ���ϵͼ�л���t1��t5�淴Ӧ���ʡ�t5��t6����Ӧ���ʵı仯�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 830 | 1 | 4 | 0.8 | 0.8 | 3 |
| 3 | 830 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com