
A、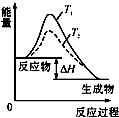 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、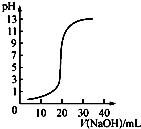 表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液 |
C、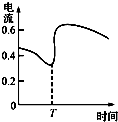 表示Zn、Cu和稀硫酸构成的原电池中电流强度的变化,T时加入了H2O2 |
D、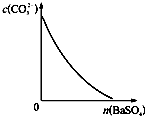 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |


科目:高中化学 来源: 题型:
| A、酱油 | B、面粉 | C、海带 | D、菜油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
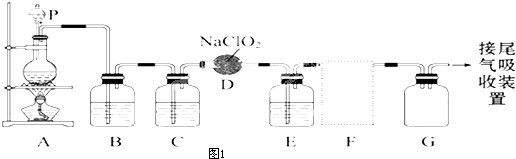
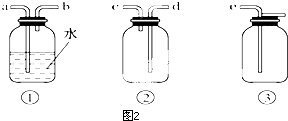
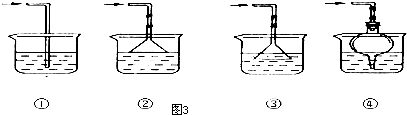
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | ||||
| D、Ba(OH)2溶液中滴加过量NaHSO4:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 实验步骤 | 实验现象 | 离子方程式 |
| SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
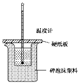 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com