
在密闭容器中进行如下反应:X(g)+Y(g)⇌2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,达到平衡时,各物质的浓度不可能是( )
|
| A. | Z为0.3 mol/L | B. | Y为0.15 mol/L |
|
| C. | X为0.1 mol/L | D. | Z为0.4 mol/L |
考点:
化学反应的可逆性.
专题:
化学平衡专题.
分析:
化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:
解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.1 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.3 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.1<c(Y2)<0.3,0<c(Z)<0.4,
所以Z不可能为0.4 mol/L,故D错误.
故选D.
点评:
本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如下图所示.关于该电池的叙述正确的是( )
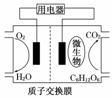 A.该电池能够在高温下工作
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2
气体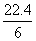 L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
|
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
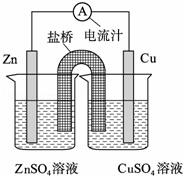
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述中,正确的是( )
|
| A. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(1)△H=+57.3kJ/mol |
|
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ |
|
| D. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
|
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
|
| C. | 用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
|
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,取100 mL某酸溶液,测得其pH等于1,下列叙述正确的是 ( )。
A.该溶液中的c(H+)≥0.1 mol·L-1
B.把该溶液稀释成1 L后,pH≥2
C.把该溶液稀释成1 L后,pH<2
D.完全中和此溶液需0.1 mol·L-1 NaOH的体积≥100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在密闭的容器中,发生可逆反应:xA(g)+yB(g) zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
A. x+y < z B.A的转化率减小
C.B的百分含量减小 D.平衡向正方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com